Навигация
Основы термодинамики
1. Основы термодинамики
2.1. Первое начало термодинамики
Внутренняя энергия макроскопической системы качественно отличается от механической энергии, образующих систему частиц. Это проявляется в существовании двух форм изменения внутренней энергии – работы и теплопередачи (теплообмена). Работа совершается в тех случаях, когда при взаимодействии системы с окружающими телами, возникает какое – либо упорядоченное движение. В, частности, газ совершает работу только при изменении его объема. В процессе теплопередачи также может происходить изменение внутренней энергии, обусловленное изменением энергии, образующих систему частиц, и не связанное с совершением работы. Изменение внутренней энергии в этом случае измеряется количеством тепла.
Закон сохранения энергии, в котором учитывается особая форма передачи энергии путем теплопередачи, является фундаментальным законом физики и называется первым началом термодинамики.
«Количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами)»
![]()
Первое начало сформулировано на основании обобщения опытных фактов и справедливо для всех тепловых процессов. Последнее соотношение является термодинамическим определением внутренней энергии системы.
«Внутренняя энергия системы является функцией ее состояния, определенной с точностью до произвольной постоянной, приращение которой равно разности между количеством тепла, полученным системой и работой, совершенной системой в ходе теплового процесса».
Изменение внутренней энергии зависит только от начального и конечного состояний системы. Работа и количество тепла зависят от вида процесса, переводящего систему из начального состояния в конечное, т.е. они не являются функциями состояния системы.
Если система периодически возвращается в первоначальное состояние, то DU=0 и A=Q, т.е. нельзя построить вечный двигатель, который совершал бы большую по величине работу, чем количество сообщенной ему извне энергии.
По форме обмена энергией можно выделить три вида систем:
1) изолированные (dQ=0, dA=0),
2) теплоизолированные (адиабатические) (dQ=0, dA¹0),
3) тепловые резервуары (dA=0, dQ¹0).
2.2. Работа газа при изменении его объема
Найдем работу, совершаемую газом при изменении его объема. Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде (рис. 17).
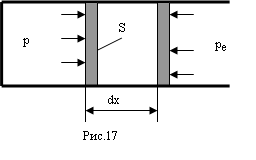 Если газ, расширяясь, передвигает поршень на расстояние dx, то он производит работу против сил внешнего давления ре
Если газ, расширяясь, передвигает поршень на расстояние dx, то он производит работу против сил внешнего давления ре
![]() ,
,
где S - площадь поршня, dV - изменение объема газа. Полная работа А12 , совершаемая газом при изменении его объема от V1 до V2
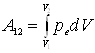 .
.
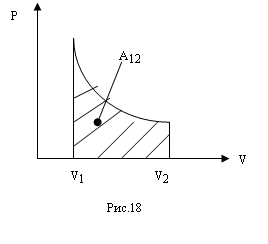 Если процесс расширения газа является равновесным, т.е. идущим без перепадов давлений и температур, то работа может быть вычислена через давление самого газа (ре=р). Графически работа газа равна площади под кривой процесса в диаграмме PV (рис.18). Если газ совершает круговой процесс (цикл), то работа будет равна площади цикла.
Если процесс расширения газа является равновесным, т.е. идущим без перепадов давлений и температур, то работа может быть вычислена через давление самого газа (ре=р). Графически работа газа равна площади под кривой процесса в диаграмме PV (рис.18). Если газ совершает круговой процесс (цикл), то работа будет равна площади цикла.
Работа газа при изопроцессах:
1. Изохорический
V=const, dV=0, A12=0.
2. Изотермический
T=const,  .
.
3. Изобарический
P=const, 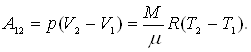
2.3. Теплоемкость
Теплоемкость тела или системы - скалярная физическая величина, характеризующая процесс теплообмена и равная количеству тела, полученному системой при изменении его температуры на один кельвин.
![]()
Теплоемкость можно отнести к одному молю или к единице массы вещества. Соответствующие теплоемкости называются молярной Сm или удельной с. Единицами измерения теплоемкостей являются: полной –Дж/К, молярной – Дж/(моль)×К, удельной - Дж/кг×К. Зная теплоемкости можно вычислить количество тепла, полученное системой:
Q=CDT, Q=nCmDT, Q=cMDT.
Теплоемкость, как и количество тепла, зависит от вида теплового процесса. Различают теплоемкости при постоянном давлении и постоянном объеме, если в процессе нагревания вещества поддерживаются постоянными соответственно давление и объем. Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщенная газу извне теплота идет на увеличение его внутренней энергии
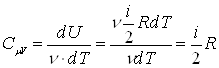
Используя первое начало термодинамики можно показать, что молярная теплоемкость газа при постоянном объеме CmV и молярная теплоемкость газа при постоянном давлении CmP связаны соотношением: ![]() . Это соотношение называется уравнением Майера.
. Это соотношение называется уравнением Майера.
При рассмотрении тепловых процессов важно знать характерное для каждого газа отношение CP к CV:
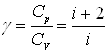 .
.
Из последних формул следует, что молярные теплоемкости не зависят от температуры в тех областях, где g = const.
Похожие работы
... значениями этих параметров, чтобы определить предельные значения и шаг расчёта рассчитываемых параметров. Заключение Хочется выразить уверенность, что в следующих версиях курса "Открытая физика" количество компьютерных моделей будет расти, их функциональные возможности станут разнообразнее, а пределы изменения числовых значений параметров, описывающих эксперименты, будут расширены. Надеемся, что ...
... это количество вещества, взятая в количестве 1 моля. g - количество вещества или число молей. [g]= моль [m]= кг/моль Билет № 7 1. Важным понятием в молекулярной физике и термодинамике является понятие термодинамической системы, к рассмотрению которого мы и переходим. 1.Термодинамической системой (или просто системой) называют совокупность большого числа молекул, атомов или ионов ...
... что разрешало противоречие между результатами Гей-Люссака и Дальтона. Успехи учения об атомно-молекулярном строении вещества, в особенности, газов, безусловно, оказало влияние на становление термодинамики и молекулярной физики и способствовало развитию механической теории теплоты. Во второй половине 18 века господствовала теория теплорода, но уже в начале 19 века она стала уступать свои позиции ...
... : Будем считать величину , измеряемую в энергетических единицах, прямо пропорциональной температуре , выражаемой в градусах: , где - коэффициент пропорциональности. Коэффициент , в честь австрийского физика Л.Больцмана называется постоянной Больцмана. Следовательно, . Температура, определяемая этой формулой, не может быть отрицательной. Следовательно, наименьшим возможным значением температуры ...
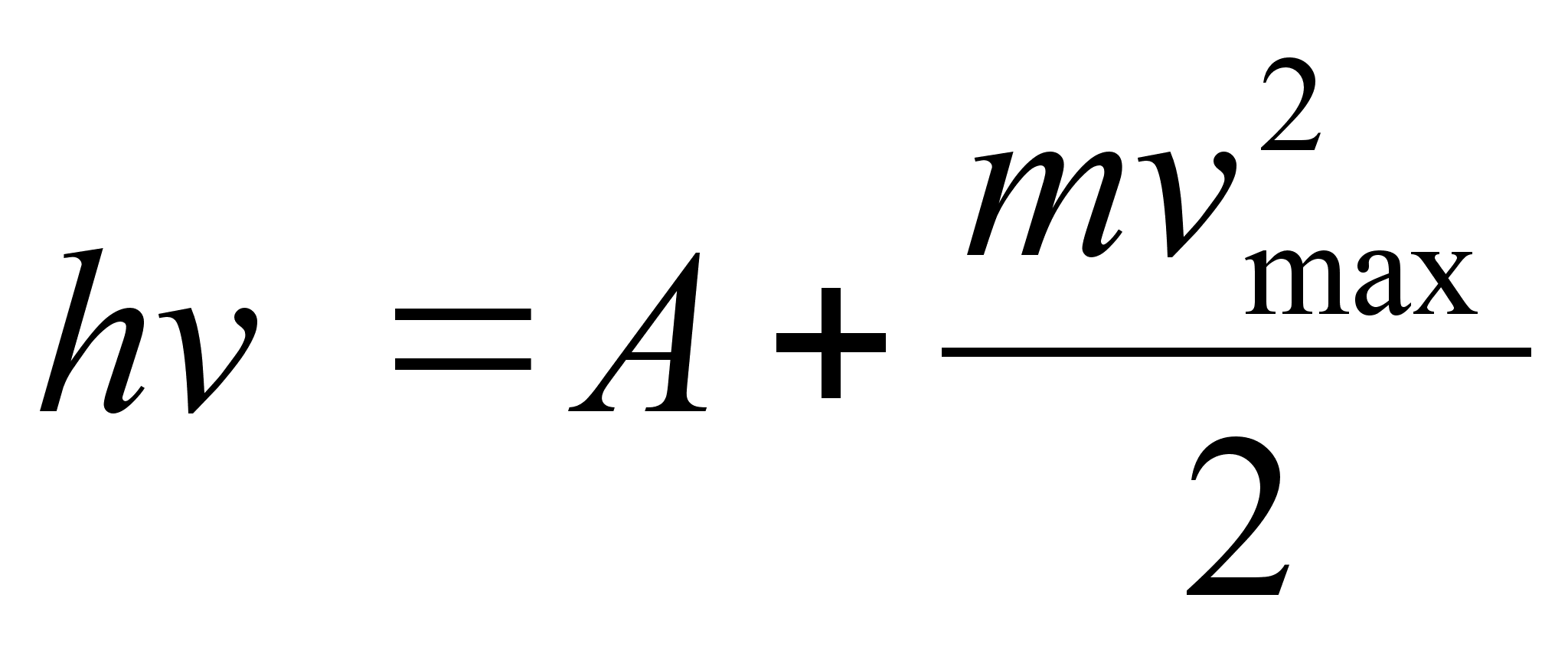


0 комментариев