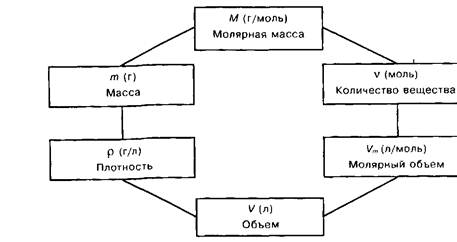
Навигация
Реакции нулевого порядка. Скорость этих реакций не зависит от концентрации реагирующего вещества n=0. Из уравнений 1.3.1 и 1.3.3 получим следующее
1. Реакции нулевого порядка. Скорость этих реакций не зависит от концентрации реагирующего вещества n=0. Из уравнений 1.3.1 и 1.3.3 получим следующее
w=k или ![]() . (1.3.4)
. (1.3.4)
Интегрируя выражение (1.3.4) получаем:
CA,t=CA,0 – k0t, k0t = CA,0 – CA,t (1.3.5)
Введем понятие время полупревращения t1/2– это время, в течение которого превращается половина исходного вещества.
Для реакции нулевого порядка в уравнение 1.3.5 подставим ![]()
t1/2=![]()
w=![]() ;
; ![]()
lnCA,t= lnCA,0 – kt
С=СА,t=CA,0 e-kt
t1/2= ![]()
3. Реакции второго порядка. Для реакции второго порядка n=2 типа
А + В ® Р1+ Р2 +..., если СА,0=СВ,0 кинетическое уравнение имеет вид
w=![]() ;
; ![]()
![]()
t1/2![]()
![]()
Для реакции второго порядка типа А + В ® Р + … если СА,0 ¹СВ,0 кинетическое уравнение имеет вид
w=![]()
Периоды полураспада вещества А и В, если СА,0 ¹СВ,0, различны,
т.е. t1|2 (A)¹ t1|2 (B).
4. Реакции третьего порядка. Кинетика реакции третьего порядка n=3 типа
2А + В ® Р1+ Р2 + … 3А ® Р1+ Р2 + …, А + В + С ® Р1+ Р2 + …
при равных начальных концентрациях описывается уравнением
w=![]()
t1|2=![]()
Для реакции А + В + С ® Р + …,если СА,0 ¹СВ,0¹СС,0 кинетическое уравнение примет вид
w=![]()
II. Выражение (1.3.1) записано для фиксированной температуры. Для приближенной оценки изменения скорости широко используется эмпирическое правило Вант-Гоффа, в соответствии с которым скорость химической реакции становится в 2-4 раза больше при повышении температуры на каждые 10°C. В математической форме зависимость изменения скорости реакции от температуры выражается уравнением
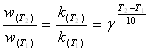 (1.3.4)
(1.3.4)
![]() — скорость реакции при повышенной температуре Т2,
— скорость реакции при повышенной температуре Т2,
![]() - скорость реакции при начальной температуре Т1; γ —температурный коэффициент скорости, показывающий, во сколько раз увеличится скорость реакции при повышении температуры на 10°С (2-4). Это позволяет предположить, что между скоростью реакции и температурой должна существовать экспоненциальная зависимость. Точное соотношение между скоростью реакции и температурой установил шведский химик Аррениус в 1899 г. Это соотношение, получившее название уравнение Аррениуса, имеет вид
- скорость реакции при начальной температуре Т1; γ —температурный коэффициент скорости, показывающий, во сколько раз увеличится скорость реакции при повышении температуры на 10°С (2-4). Это позволяет предположить, что между скоростью реакции и температурой должна существовать экспоненциальная зависимость. Точное соотношение между скоростью реакции и температурой установил шведский химик Аррениус в 1899 г. Это соотношение, получившее название уравнение Аррениуса, имеет вид
![]() (1.3.5)
(1.3.5)
где k – константа скорости реакции; А — постоянная, характеризующая каждую конкретную реакцию (константа Аррениуса, или «предэкспонента»);
Еa — постоянная, характерная для каждой реакции и называемая энергией активации, Дж; R — универсальная газовая постоянная Дж/(К*моль);
Т — температура, К.
Подчеркнем, что это уравнение связывает температуру не со скоростью реакции, а с константой скорости. Приведем уравнение Аррениуса для двух температур
![]()
III. Одно из наиболее сильных средств влияния на скорость реакции — присутствие в реагирующей системе катализатора - вещества, которое усиливают (а иногда и понижают - тогда его называют ингибитором) скорость химической реакции, но само не расходуется в этом процессе.
Примеры решения задач
1. Во сколько раз увеличится скорость химической реакции при повышении температуры с 0 до 50°С, принимая температурный коэффициент скорости равным трем?
Решение:
В математической форме зависимость изменения скорости реакции от температуры выражается уравнением![]() =
=![]() γ
γ![]()
Температура увеличивается на 50°С, а γ = 3. Подставляя эти значения, получим ![]() = 3
= 3![]() = 243
= 243
Ответ: скорость увеличится в 234 раза.
2. Для реакции первого порядка А→2В определите время за которое прореагировало на 90% вещества А. Константа скорости реакции 1*10-4 с-1.
Решение:
А → 2В
![]() ;
; ![]() ;
;
C0,A- CA=0,9 C0,A
CA = 0,1 C0,A
k1t = lnC0,A- lnCA
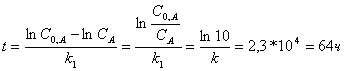 Ответ: 64 ч.
Ответ: 64 ч.
3. Как изменится скорость реакции 2А+В2![]() 2АВ, протекающей и закрытом сосуде, если увеличить давление в 4 раза?
2АВ, протекающей и закрытом сосуде, если увеличить давление в 4 раза?
Решение:
По закону действия масс скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ: w=![]() . Увеличивая в сосуде давление, мы тем самым увеличиваем концентрацию реагирующих веществ. Пусть начальные концентрации А и В равнялись [А] =а,
. Увеличивая в сосуде давление, мы тем самым увеличиваем концентрацию реагирующих веществ. Пусть начальные концентрации А и В равнялись [А] =а,
[В]=b. Тогда w=ka2b. Вследствие увеличения давления в 4 раза увеличились концентрации каждого из реагентов тоже в 4 раза и стали [A]=4a, [B]=4b.
При этих концентрациях w1 =k(4а)2 *4b = k64а2b. Значение k и обоих случаях одно и то же. Константа скорости для данной реакции есть величина постоянная, численно равная скорости реакции при молярных концентрациях реагирующих веществ, равных 1. Сравнивая w и w1, видим, что скорость реакции возросла в 64 раза. Ответ: скорость реакции возросла в 64 раза.
Похожие работы
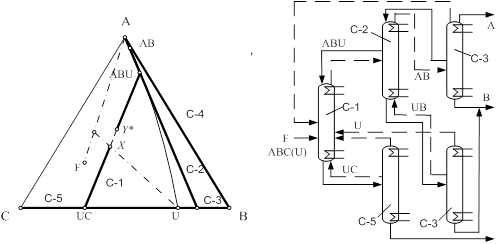
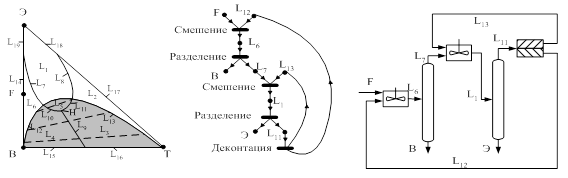
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
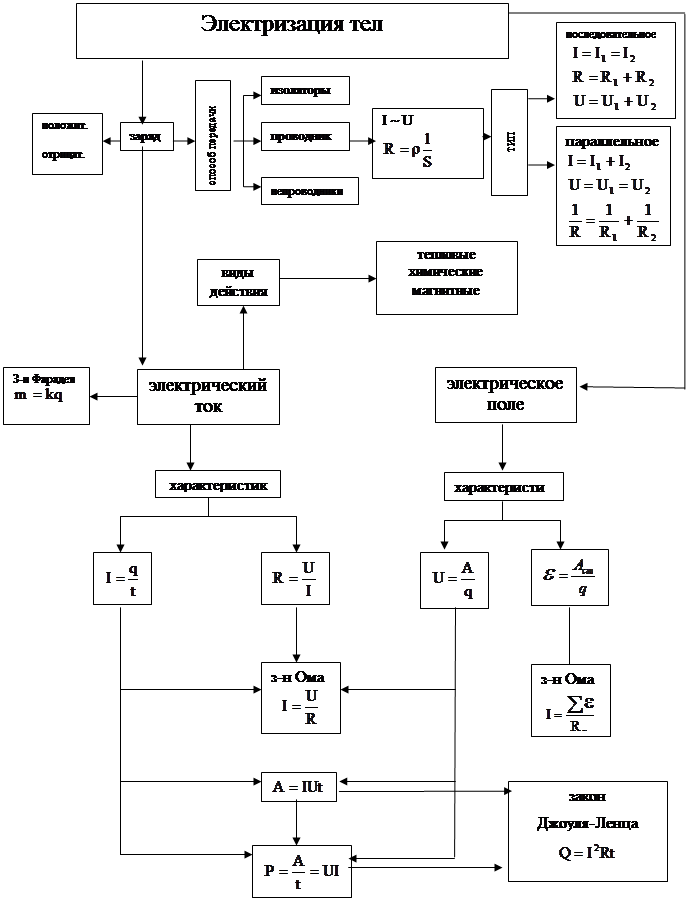
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
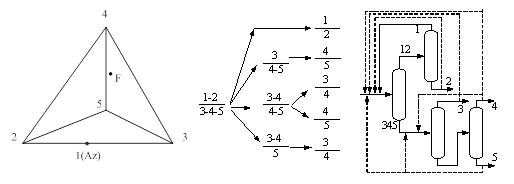
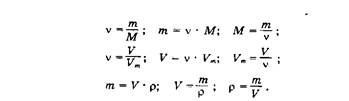

0 комментариев