Навигация
Вычислить тепловой эффект реакции получения гидроксида кальция
1. Вычислить тепловой эффект реакции получения гидроксида кальция
СаО(т) + Н2О(ж) = Са(ОН)2(т), если теплота образование СаО(т) равна +635701,5Дж/моль, теплота образования Н2О(ж) +285835,5 Дж/моль и теплота образования Са(ОН)2 +986823 Дж/моль.
Решение:
Тепловой эффект реакцииСаО (т) + Н2О (ж) = Са(ОН)2(т) по первому следствию закона Гесса, будет равен теплоте образования Са(ОН)2(т) минус теплота образования Н2О(ж) и теплота образования (СаО(т)):
ΔrН0298 =∑(nj •ΔfН0298)прод - ∑(ni• ΔfН0298)исх.
ΔrН0298=1 моль•ΔfН0298(Са(ОН)2(т))- (1 моль ΔfН0298(СаО(т))+
+1 моль• ΔfН0298(Н2О (ж)))=1 моль*986823 Дж/моль - (1 моль* 635701,5 Дж/моль +
+ 1 моль*285835,5 Дж/моль)= 65 286 Дж.
Ответ: 65286 Дж.
2. Вычислите изменения энергии Гиббса в реакции димеризации диоксида азота при стандартной температуре, при 0 и 100ºС. Сделать вывод о направлении процесса.
Решение:
При стандартной температуре 298 К изменение энтальпии в реакции
2NO2(г)![]() N2O4(г) равно (первое следствие закона Гесса)
N2O4(г) равно (первое следствие закона Гесса)
ΔrН0298 =∑(nj •ΔfН0298)прод - ∑(ni• ΔfН0298)исх.
Δ rН0298 =1 моль* 9660 Дж/моль – 2 моль*33800 Дж/ моль = - 57940 Дж
Изменение температуры равно
ΔrS0298 =∑ (nΔfS0298) прод. –∑(nΔfS0298)исход = 1 моль*304 Дж/моль*К -
–2 моль*234 Дж/моль*К = - 164 Дж/К
Зависимость энергии Гиббса реакции от температуры описывается уравнением
ΔG0T =ΔH0T – TΔS0T
При стандартной температуре
ΔrG0298=ΔH 0298– TΔS0298 = - 57940 Дж – (298 К*(-164 Дж/К)) = -9068 Дж/моль
Отрицательное значение энергии Гиббса реакции говорит о том, что смещении равновесия вправо (самопроизвольный процесс), т.е. в сторону образования диоксида азота.
При 0ºС (273К)
ΔrG0273 = -57940 Дж + 273К* 164 Дж/К = -13168 Дж/моль
Более высокое отрицательное значение ΔG273 по сравнению с ΔG0298 свидетельствует о том, что при 273 К равновесие еще больше смещено в сторону прямой реакции.
При 100ºС (373 К)
ΔrG373 = -57940 Дж + 373К*164 Дж/К = 3232 Дж/моль.
Положительная величина ΔG373 указывает на изменение направления реакции: равновесие смещено влево, т.е. в сторону распада димера N2O4 (реакция невозможна). Ответ: при 0ºС (273 К) ΔrG273= -13168 Дж/моль, реакция протекает самопроизвольно; при 100ºС (373 К) ΔrG373= 3232 Дж/моль, реакция невозможна.
3. Составьте термохимическое уравнение горения метана СН4 и рассчитайте объем воздуха, необходимый для сжигания 1моль метана, если известно, что при сгорании 5,6 л метана выделяется 220 кДж теплоты, содержание кислорода в воздухе равно 20%.
Решение:
СН4 + 2О2 = СО2 + 2Н2О, ∆Н<0
Находим количество вещества метана объемом 5,6 л
![]()
Если при сгорании СН4 количеством вещества 0,25 моль выделяется 220 кДж теплоты, то при сгорании СН4 количеством вещества 1 моль выделяется 880 кДж теплоты.
Термохимическое уравнение:
СН4 +2О2 = СО2+ 2Н2О+ 880 кДж
Из уравнения реакции видно, что на сгорание СН4 количеством вещества 1моль расходуется О2 количеством вещества 2 моль, на сгорание СН4 количеством вещества 0,25 моль расходуется х моль О2, откуда х = 0,5 моль.
Кислород количеством вещества 0,5 моль занимает объем 11,2 л.
В воздухе 20% кислорода, следовательно, объем воздуха будет равен
![]()
Ответ: 880 кДж, 56 л.
Задачи для самостоятельного решения1. Рассчитайте, какая из ниже перечисленных реакций при стандартных условиях может идти самопроизвольно:
а) Fe(к) + Al2O3(к) = Al(к) + Fe2O3(к)
б) Al(к) + Fe2O3 (к)= Fe(к) + Al2O3(к)
в) CuSO4(к) + 2NH4OH(ж) = Cu(OH)2(к) + (NH4)2SO4(к)
г) Al2O3(корунд) + 3SO3 = Al2(SO4)2(к)
2. При сварке трамвайных рельсов используют термитную смесь, которую готовят, смешивая порошки алюминия и оксида железа (III) в количественном отношении 2:1. Термохимическое уравнение горения термитной смеси следующее: 2Al + Fe2O3= Al2O3 + 2Fe + 829,62 кДж. Сколько теплоты выделится при образовании: 1) 4 моль железа; 2) 1 моль железа?
3. Рассчитайте, достаточно ли теплоты, выделяющейся при сгорании 200 кг каменного угля, содержащего 82% углерода, для полного разложения 162 кг карбоната кальция, если для разложения 1 моль СаСО3 необходимо 180 кДж теплоты, а при сгорании 1 моль углерода, входящего в состав каменного угля, выделяется 402 кДж теплоты.
Похожие работы
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
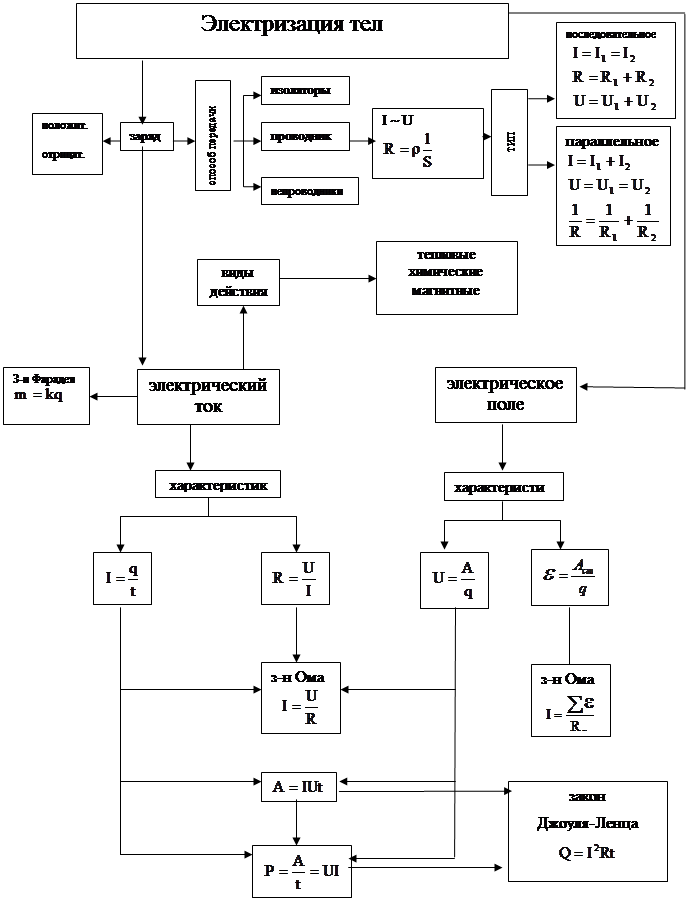
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
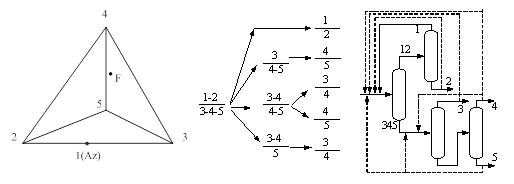

0 комментариев