Навигация
Реакция соединения азота и водорода обратима и протекает по уравнению
1. Реакция соединения азота и водорода обратима и протекает по уравнению
N2 + 3Н2![]() 2NН3. При состоянии равновесия концентрации участвующих в ней веществ были: [N2] = 0,01 моль/л, [Н2] = 2,0 моль/л, [NH3] = 0,40 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
2NН3. При состоянии равновесия концентрации участвующих в ней веществ были: [N2] = 0,01 моль/л, [Н2] = 2,0 моль/л, [NH3] = 0,40 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
Решение:
Для приведенной реакции
![]()
Подставляя значение равновесных концентраций, получим
![]() = 2
= 2
Согласно уравнению реакции из 1 моль азота и 3 моль водорода получаем
2 моль аммиака, следовательно, на образование 0,4 моль аммиака пошло
0,2 моль азота и 0,6 моль водорода. Таким образом, исходные концентрации будут [N2] = 0,01 моль/л + 0,2 моль/л = 0,21 (моль/л),
[H2] = 2,0 моль/л + 0,6 моль/л = 2,6 (моль/л).
Ответ: Кравн = 2; С0 (N2) = 0,21 моль/л и С0 (Н2) = 2,6 моль/л.
2. Один моль смеси пропена с водородом, имеющей плотность по водороду 15, нагрели в замкнутом сосуде с платиновым катализатором при 320°С, при этом давление в сосуде уменьшилось на 25%. Рассчитайте выход реакции в процентах от теоретического. На сколько процентов уменьшится давление в сосуде, если для проведения эксперимента в тех же условиях использовать 1 моль смеси тех же газов, имеющей плотность по водороду 16?
Решение:
С3Н6 + Н2![]() С3Н8
С3Н8
1) Пусть ν(C3H6) = х, ν(H2) =1-x, тогда масса смеси равна
42х + 2(1 - х) = 2 • 15 = 30,
откуда х = 0,7 моль, т. е. ν(C3H6) = 0,7 моль, ν(H2) = 0,3 моль.
Давление уменьшилось на 25% при неизменных температуре и объеме за счет уменьшения на 25% числа молей в результате реакции. Пусть у моль Н2 вступило в реакцию, тогда после реакции осталось:
ν(C3H6) = 0,7 - у, ν(H2) = 0,3 – у, ν(C3H8) = у,
νо6щ = 0.75 =(0,7 - у) + (0,3 - у) + у, откуда y = 0,25 моль.
Теоретически могло образоваться 0,3 моль С3Н8 (H2 — в недостатке), поэтому выход равен ![]() . Константа равновесия при данных условиях равна
. Константа равновесия при данных условиях равна
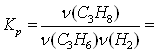
![]()
2) Пусть во втором случае ν(C3H6) = a моль, ν(H2) = (1 – а) моль, тогда масса смеси равна 42а + 2(1 - а) = 2 • 16 = 32, откуда, а= 0,75, т. е. ν(C3H6) = 0,75, ν(H2) = 0,25. Пусть в реакцию вступило b моль Н2. Это число можно найти из условия неизменности константы равновесия
![]() =
=![]()
Из двух корней данного квадратного уравнения выбираем корень, удовлетворяющий условию 0 < b < 0,25, т. е. b = 0,214 моль
Общее число молей после реакции равно
νoбщ =((0,75 - 0,214) + (0,25 - 0,214) + 0,214 - 0,786) моль, т. е. оно уменьшилось на 21,4% по сравнению с исходным количеством (1 моль). Давление пропорционально числу молей, поэтому оно также уменьшилось на 21,4%.
Ответ: выход С3Н8 — 83,3%; давление уменьшится на 21,4%.
Задачи для самостоятельного решения
1. В реакции между раскаленным железом и паром
3Fe(тв) + 4Н2О(г) ![]() Fe3O4(тв)+4Н2(г), при достижении равновесия парциальные давления водорода и пара равны 3,2 и 2,4 кПа соответственно. Рассчитайте константу равновесия.
Fe3O4(тв)+4Н2(г), при достижении равновесия парциальные давления водорода и пара равны 3,2 и 2,4 кПа соответственно. Рассчитайте константу равновесия.
2. Вычислите константы равновесия Кр КС газовой реакции
СО + Cl2 ![]() СОCl2, состав газовой смеси при равновесии был следующим (% по объему): СО=2,4, Cl2 =12,6, СОCl2 =85,0, а общее давление смеси при 20С составляло 1,033*105 Па. Вычислите ΔG реакции.
СОCl2, состав газовой смеси при равновесии был следующим (% по объему): СО=2,4, Cl2 =12,6, СОCl2 =85,0, а общее давление смеси при 20С составляло 1,033*105 Па. Вычислите ΔG реакции.
3. Рассчитайте константу равновесия при некоторой заданной данной температуре для обратимой реакции СО + Н2О![]() СО2 + Н2, учитывая, что в состоянии равновесия концентрации участвующих в реакции веществ были равны [СО] = 0,16 моль/л, [Н2О] = 0,32 моль/л, [СО2] = 0,32 моль/л, [Н2] = 0,32 моль/л.
СО2 + Н2, учитывая, что в состоянии равновесия концентрации участвующих в реакции веществ были равны [СО] = 0,16 моль/л, [Н2О] = 0,32 моль/л, [СО2] = 0,32 моль/л, [Н2] = 0,32 моль/л.
4. В стальном резервуаре находятся карбонат кальция и воздух под давлением 1 атм. при температуре 27°С. Резервуар нагревают до 800°С и дожидаются установления равновесия. Вычислите константу равновесия Кр реакции CaCO3![]() СаО + СО2 при 800°С, если известно, что равновесное давление газа в резервуаре при этой температуре равно 3,82 атм., а при 27°С СаСО3 не разлагается.
СаО + СО2 при 800°С, если известно, что равновесное давление газа в резервуаре при этой температуре равно 3,82 атм., а при 27°С СаСО3 не разлагается.
5. При постоянной температуре в гомогенной системе А + В = 2С установилось равновесие с равновесными концентрациями [А]=0,8 моль/ль, [В]=0,6 моль/л, [С]=1,2 моль/л. определите новые равновесные концентрации, если в систему дополнительно ввели 0,6 моль/л вещества В.
6. Как можно обосновать оптимальные условия промышленного синтеза аммиака с высоким выходом на основе термохимического уравнения реакции
N2 + ЗН2![]() 2NH3 + 491,8 кДж и с учетом того, что при низких температурах скорость прямой реакции очень мала?
2NH3 + 491,8 кДж и с учетом того, что при низких температурах скорость прямой реакции очень мала?
Похожие работы
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...

0 комментариев