Навигация
Вычислите константу равновесия ниже приведенных реакции, протекающей при стандартных условиях и при 400К
7. Вычислите константу равновесия ниже приведенных реакции, протекающей при стандартных условиях и при 400К.
а) Na2O(к) + CO2(г) → Na2CO3(к)
б) N2O4(г) = 2NO2(г)
8. Уравнение реакции окисления хлорида водорода
4НСl (г) + O2(г) = 2H2O(г) + 2Cl2(г) Вычислите константу равновесия этой реакции при Т=500К. Предположите способы увеличения концентрации хлора в равновесной смеси.
9. При смешении 2 моль уксусной кислоты и 2 моль этилового спирта в результате реакции СН3СООН + С2Н5ОН = СН3СООС2Н5 + Н2О к моменту наступления равновесия осталось 0,5 моль СН3СООН и С2Н5ОН, а также некоторое количество эфира и воды. Определите состав равновесной смеси, если смешивают по 3 моль СН3СООН и С2Н5ОН при той же температуре.
10. Вычислить начальные концентрации веществ в обратимой реакции
2СO +О2![]() 2СО2 и константу равновесия, если равновесные концентрации составляют [СО]=0,44 моль/л, [О2]=0,12 моль/л, [СО2] =0,18 моль/л.
2СО2 и константу равновесия, если равновесные концентрации составляют [СО]=0,44 моль/л, [О2]=0,12 моль/л, [СО2] =0,18 моль/л.
3.1.3 Химическая кинетика
Это раздел физической химии, изучающей скорость химических реакций, а в более широком смысле – закономерности их протекания.
Термин скорость реакции означает скорость, с которой образуются продукты, либо скорость, с которой расходуются агенты при протекании химической реакции. Химические реакции происходят с самыми разными скоростями. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Основным понятием в химической кинетике является понятие о скорости реакции, которая определяется изменением количества вещества реагентов (или продуктов реакции) в единицу времени в единице объема. Если при неизменном объеме и температуре концентрация одного из реагирующих веществ уменьшилась (или увеличилась) от значения с1 до значения с2за промежуток времени от t1 до t2, то средняя скорость реакции составит
![]() (1.3.1)
(1.3.1)
где DСi – изменения концентрации i-того компонента, моль/м3 или моль/л,
wi - скорость реакции, (моль/(л • с) или моль/м3 *с). Уравнение (1.3.1) подходит для реакций протекающих в гомогенном реакционном пространстве.
Если реакция протекает в гетерогенном пространстве, то выражение для скорости реакции по данному веществу i имеет вид (моль/м3 *с).
![]() (1.3.2)
(1.3.2)
dni– изменение количества i-того компонента, моль; S- площадь, м2;
dt – изменение времени, с.
I. Продукты реакции или промежуточные соединения образуются при взаимодействии частиц в элементарном химическом акте. Число частиц в элементарном химическом акте называется молекулярностью реакции. Элементарные реакции бывают трех типов:
- мономолекулярные А ® Р1+ Р2 + …
- бимолекулярные А + В ® Р1+ Р2 +...
- тримолекулярные 2А + В ® Р1+ Р2 + … 3А ® Р1+ Р2 + …,
А + В + С ® Р1+ Р2 + …
Четырехмолекулярных реакций не бывает, т.к. вероятность одновременного столкновения четырех молекул ничтожно мала.
Скорость реакции можно измерить, определяя количество реагента или продукта во времени. Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшими из них являются концентрация, температура и присутствие катализатора.
Рассмотрим реакцию между веществами А и В, протекающую по схеме
аА + вВ + …. → сС + dD + …
Скорость реакции зависит от концентраций А и В, однако заранее нельзя утверждать, что она прямо пропорциональна концентрации того или другого. Зависимость скорости химической реакции от концентрации реагирующих веществ выражается основным законом химической кинетики — законом действующих масс: скорость элементарной химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для элементарной реакции
n1А + n2В ® n3С + n4Е + …
w= ![]() или w = k [A]nA [B]nВ. (1.3.3)
или w = k [A]nA [B]nВ. (1.3.3)
Выражение такого типа называют кинетическим уравнением, где k - константа скорости (не зависит от концентрации реагирующих реагентов и времени); CA, CB – текущие концентрации реагирующих веществ; n1, n2- некоторые числа, которые называются порядком реакции по веществам А и В соответственно. Порядок реакции совпадает со стехиометрическими показателями элементарной реакции. Порядок реакции n – сумма показателей кинетических степеней в химическом уравнении реакции. Сумма показателей степеней n1 + n2 = n называется общим порядком реакции. Для элементарной реакции общий порядок равен молекулярности, а порядок по веществам равны коэффициентам в уравнении реакции. Порядок реакции по i-тому компоненту не равен его стехиометрическому коэффициенту в химическом уравнении сложной реакции.
Похожие работы
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
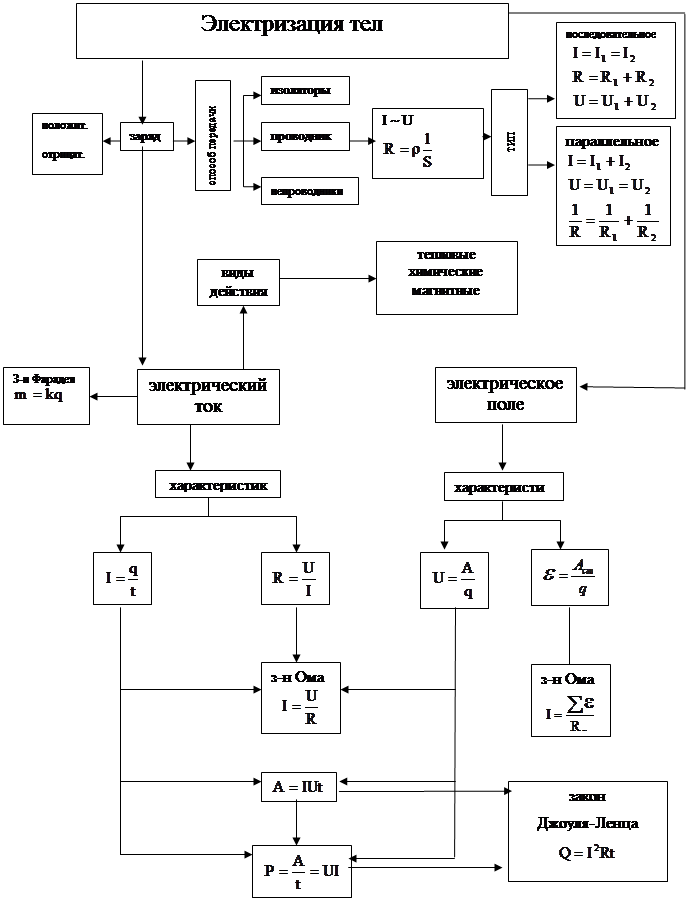
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
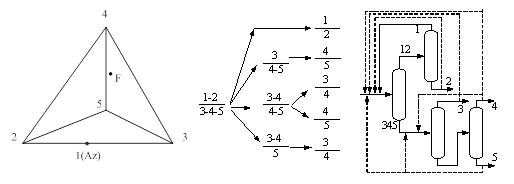

0 комментариев