Навигация
Электрохимические производства
3.4.2 Электрохимические производства
Электролизом называется окислительно-восстановительная реакция, протекающая при пропускании постоянного электрического тока через расплав или раствор электролита.
Сущность электролиза заключается в следующем: при пропускании электрического тока через расплав или раствор электролита положительные ионы электролита (ионы металлов или водорода) притягиваются катодом, а отрицательные ионы (кислотные остатки или гидроксильные группы) — анодом. Приносимые к катоду от источника тока электроны присоединяются к положительным ионам электролита, восстанавливая их. Одновременно отрицательные ионы электролита отдают свои электроны аноду, от которого они двигаются к источнику тока. Теряя свои электроны, они окисляются в нейтральные атомы или группы атомов. Таким образом, у катода протекает процесс восстановления, а у анода — процесс окисления.
А (+): nAn- - ne- → nAp-
K (-): nBn+ + ne- → nBp+
Оба процесса образуют единую окислительно-восстановительную реакцию. Но в отличие от обычных окислительно-восстановительных реакций электроны от восстановителя к окислителю переходят не прямо, а посредством электрического тока. Катод, приносящий электроны, является восстановителем, а анод, уносящий их,— окислителем.
Основными показателями электрохимических производств являются выход по току, степень использования энергии. Расходный коэффициент по энергии, напряжение, приложенное к электролизеру, и др. Большинство вычислений основано на законе Фарадея, согласно которому масса вещества, выделившегося при электролизе пропорционально силе тока I, времени электролиза t и электрохимическому эквиваленту этого вещества ЭЭ
Масса вещества вычисляется по формуле
![]() (1.3.1)
(1.3.1)
где, I - сила тока, F – постоянная Фарадея (96500 Кл)
![]() (г-экв) (1.3.2)
(г-экв) (1.3.2)
Mr – относительная молекулярная масса вещества,
n – заряд иона (абсолютное значение) в виде которого вещество находится в растворе или в расплаве (т.е. количество отданных или принятых электронов).
Выход по току определяется отношением массы вещества, выделившегося при электролизе, к массе вещества, которое теоретически должно выделится согласно закону Фарадея, и выражается в процентах:
![]() (1.3.3)
(1.3.3)
Масса mтеор находится по формуле
![]()
![]() (1.3.4)
(1.3.4)
Выход по энергии определяется по уравнению
![]() (1.3.5)
(1.3.5)
где, Етеор и Епр – теоретическое и практическое напряжение разложения при электролизе соответственно, В; η - выход по энергии,%.
Выход по энергии может быть вычислен и по количеству затраченной энергии:
![]() (1.3.6)
(1.3.6)
где wтеор и wпр – количество энергии, теоретически необходимое и практически затраченное на получение единицы продукта.
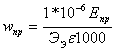 (1.3.7)
(1.3.7)
где 1000 – коэффициент перевода Вт*ч в кВт*ч;
1*10-6 – число, используемое для перевода граммов в тонны.
Теоретический расход электроэнергии находится по отношению
![]() (1.3.8)
(1.3.8)
где φразл – напряжение разложения.
Примеры решения задач
1. Какие процессы происходят при электролизе расплава гидроокиси натрия?
Решение:
В расплаве едкого натра содержатся ионы Nа+ и ОН![]() . Окисляющиеся у анода ионы ОН
. Окисляющиеся у анода ионы ОН![]() в следующей стадии разлагаются с образованием воды и кислорода. Процесс можно изобразить следующим образом:
в следующей стадии разлагаются с образованием воды и кислорода. Процесс можно изобразить следующим образом:
К(-): 2Na+ + 2е- = 2Na;
А(+): 2ОН![]() - 2e- = Н2О + О2
- 2e- = Н2О + О2
Два атома кислорода, соединяясь друг с другом, образуют молекулу кислорода О2. Таким образом, суммарное уравнение
4NаОН = 4Na + 2Н2О + О2
При электролизе расплавов солей кислородных кислот окисляющиеся ионы кислотных остатков тут же разлагаются на кислород и соответствующие оксиды.
Своеобразно протекает электролиз в водном растворе. Дело в том, что сама вода — электролит, хотя и очень слабый. Таким образом, в водном растворе фактически содержатся два электролита — растворитель и растворенное вещество и соответственно по два вида как положительных, так и отрицательных ионов. Какие из них будут разряжаться, зависит от ряда условий. Как правило, можно руководствоваться следующим. Если положительные ионы электролита являются ионами очень активных металлов, как например Na+ или К-, то при электролизе разряжаются не ионы этих металлов, а ионы водорода из воды с выделением свободного водорода и освобождением гидроксильных ионов, что может быть выражено следующим электронно-ионным уравнением:
2H+OH![]() + 2е- = Н2↑ + 2ОН
+ 2е- = Н2↑ + 2ОН![]()
Если отрицательными ионами электролита являются кислотные остатки кислородных кислот, то при электролизе разряжаются не кислотные остатки этих кислот, а ионы ОН![]() из воды с выделением кислорода, что можно выразить уравнением:
из воды с выделением кислорода, что можно выразить уравнением:
4Н2О — 4е- = 4Н+ + 4ОН![]()
4ОН-![]() 2Н2О+О2
2Н2О+О2
Складывая оба уравнения, получаем:
2Н2О — 4е- = 4H+ + O2
2. Определить выход по току (в%), если в течение 24 ч в электролизере раствора поваренной соли при силе тока 15500А было получено 4200 л электролитической щелочи с концентрацией NaOH 125 кг/м3.
Решение:
По уравнению (1.3.4) масса гидроксида натрия теоретически должна была составить
![]()
практически было получено
![]()
Следовательно, выход по току по формуле (1.3.3) будет равен
![]()
Ответ: выход по току 94,6%.
3. Определите фактический расход электроэнергии (в киловатт-часах) на получение хлора массой 1 т и выход по энергии (в%), если среднее напряжение на электролизере 3,35В, выход по току 96%, а электрохимический эквивалент хлора равен 1,323 г/А*ч.
Решение:
Использовав формулу (1.3.7), определим фактический расход энергии
![]()
Если принять выход по току за 100%, то при теоретическом напряжении разложения NaCl, равном 2,17В, теоретический расход энергии на 1т хлора составит
![]()
В этом случае выход по энергии
![]()
Ответ: выход по энергии 62,2%; 2637 кВ/ч
Задачи для самостоятельного решения
1. Один из способов промышленного получения кальция – электролиз расплавленного хлорида кальция. Какая масса металла будет получена, если известно, что в результате электролиза выделился хлор объемом 896 л (н.у.)?
2. При электролизе раствора хлорида натрия в электролизе, работавшем в течении 24ч при силе тока 30000 А, было получено 8,5 м3 электролитической щелочи с концентрацией NaOH 120 кг/м3. рассчитать выход по току (для щелочи)
3. Определить силу тока, необходимые для выработки 100% -ного гидроксида натрия массой 1720 кг в сутки в электролизере с железным катом при его непрерывной работе, если выход по току составляет 96%
4. Вычислить массу хлора, вырабатываемого за год заводом, на котором установлено 5 серий по 150 электролизеров с железными катодами при непрерывной работе в течении 350 дней, силе тока 34000 А и выходе по току 95%. Определить мощность генератора переменного тока электростанции, обеспечивающий потребности завода в электрической энергии при напряжении донной серии 550 В, если КПД выпрямителя тока составляет 95%.
5. Вычислить теоретический и практический расход электроэнергии на 1т 100% NаОН для электролиза раствора хлорида натрия с ртутным катодом. Теоретическое напряжение разложения равно 3,168 В. Определить выход по энергии, если практическое напряжение разложения 4,4 В, а выход по току 92,5%.
6. Какие вещества, и в каком количестве выделяются на угольных электродах, если состав раствора 0,1 моль HgCl2 и 0,2 моль CuCl2 и через него пропускается ток силой 10 А в течение 1 ч?
7. При прохождении электрического тока через разбавленный раствор серной кислоты в течении 10 мин выделилось 100 мл водорода при 18С и давлении
755 мм рт. ст. Вычислите силу тока.
8. При электролитическом получении магния в качестве электролита может служит расплавленных хлорид магния. Вычислите выход по току, если в ванне, работающем при силе тока 40000 А, в течении 5 ч, выделилось 72,6 кг магния.
9. Определить количество электричества, необходимое для выделения 1 м3 водорода и 0,5 м3 кислорода, получаемое при электролизе воды. Теоретическое напряжение воды равно 1,23 В, а фактическое превышает его в 1,5 – 2 раза. Рассчитать фактический расход электрической энергии.
10. При электролизе раствора содержащего 2,895 г смеси FeCl2 и FeCl3, на катоде выделилось 1,12 г металла. Вычислите массовую долю каждого из компонентов исходной смеси, если электролиз проводили до полного осаждения железа.
Похожие работы
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...

0 комментариев