Навигация
Общие вопросы химической технологии
3.1 Общие вопросы химической технологии
3.1.1 Термохимия
Термохимия — учение о тепловых эффектах химических реакций. Для решения задач по термохимии необходимо знать такие понятия, как тепловой эффект реакции, стандартная тепловой эффект образования вещества, стандартная тепловой эффект сгорания химического соединения, закон Гесса и следствия из него, возможность самопроизвольного протекания реакции, зависимость энергии Гиббса от температуры. Наиболее важным понятием химической энергетики является тепловой эффект химической реакции. Данные о тепловых эффектах применяются для определения строения и реакционной способности соединений, энергии межатомных и межмолекулярных связей, используются в технологических и технических расчетах. В основе термохимических расчетов по уравнениям реакций лежит закон сохранения и превращения энергии, или первое начало термодинамики. Сущность его состоит в том, что при всех превращениях энергия не возникает и не исчезает, а одни ее виды переходят в эквивалентные количества других видов. Количество выделившейся (поглощенной) теплоты в результате химической реакции называется тепловым эффектом реакции Q (при p-const QP или V-const QV) (измеряется в кДж). По тепловому эффекту химические реакции подразделяются на экзотермические (с выделением теплоты (+Q)) и эндотермические (с поглощением теплоты (-Q)). Существует величина обратная тепловому эффекту (записывается с противоположным знаком). Она характеризует внутреннюю энергию вещества и называется энтальпией (∆Н). Изменение энтальпии измеряют в кДж/моль, т.е. это то количество теплоты, которое выделяется или поглощается при образовании 1 моль вещества из простых веществ. С термодинамической точки зрения принимают, что тепловой эффект при постоянном давлении и температуре равен изменению энтальпии ΔН. Передачу энергии при этом рассматривают как бы со стороны самой реакционной системы. Если система отдала энергию во внешнюю среду, величина ΔН считается отрицательной ΔН<0, если реакционная система получила энергию за счет внешней среды — величину ΔН считают положительной ΔН>0. Вычисление теплоты реакции по теплотам образования участвующих в ней веществ, производится на основании закона Гесса.
Закон Гесса: Тепловой эффект химической реакции при постоянном давлении и объеме не зависит от пути реакции (т.е. от промежуточных стадий), а определяется начальным и конечным состоянием системы (т.е. состоянием исходных веществ и продуктов реакции (газ, жид., тв.)).
ΔrН0298 – стандартная энтальпия реакции (reaction), тепловой эффект реакции.
ΔfН0298 – стандартная энтальпия образования (formation) 1 моль вещества из простых веществ в стандартных условиях (Т=298К или 25С, Р=1 атм.), на которые указывает знак «0», (кДж/моль).
ΔсН0298 – стандартная энтальпия сгорания (combustion) 1 моль вещества (до образования СО2, Н2О, и др. продуктов), (кДж/моль).
Следствие 1 из закона Гесса:
Тепловой эффект химической реакции равен разности между алгебраической суммой теплот образования продуктов реакции и алгебраической суммой теплот образования исходных веществ
ΔrН0298 =∑(nj •ΔfН0298)прод - ∑(ni• ΔfН0298)исх.
где, njи ni– количество вещества продуктов реакции и исходных веществ соответственно (численно равно коэффициенту в уравнении реакции), (моль).
Следствие 2 из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции
ΔrН0298 =∑(ni• ΔсН0298)- ∑(nj• ΔсН0298)
где, ni и nj- количество вещества исходных веществ и продуктов реакции соответственно (численно равно коэффициенту в уравнении реакции), (моль).
В химических реакциях может одновременно изменяется и энергия системы и ее энтропия, поэтому реакция протекает в том направлении, в котором общая суммарная движущая сила реакции уменьшается. Если реакция происходит при постоянном температуре и давлении, то общая движущая сила реакции называется энергией Гиббса (ΔG0) и направление реакции определяется ее изменением.
Зависимость энергии Гиббса реакции от температуры описывается уравнениемΔG0T=ΔH0T – TΔS0T
При стандартной температуре
ΔG0298=ΔH 0298– TΔS0298
ΔG0298 – стандартная энергия Гиббса, изменение энергии Гиббса при образовании 1 моль вещества из простых веществ в стандартных условиях, (кДж/моль).
Стандартную энергию Гиббса реакции рассчитывают по первому следствию из закона Гесса.
∆rG 0298= ∑(njΔfG0298) прод. -∑ (niΔfG0298)исход.
ΔS0298 - стандартная энтропия 1 моль вещества в стандартном условиях, (Дж/К*моль). Энтропию можно характеризовать как меру беспорядка (неупорядоченности) системы. Эта величина характеризует изменение температуры в системе.
Поскольку энтропия – функция состояния системы, ее изменение (ΔS) в процессе химической реакции можно подсчитать, используя следствие из закона Гесса.ΔrS0298 =∑ (njΔfS0298) прод. –∑(niΔfS0298)исход
где, njи ni– количество вещества продуктов реакции и исходных веществ соответственно (численно равно коэффициенту в уравнении реакции), (моль).
ΔrS0298 =∑ (niΔfS0298) исход –∑(njΔfS0298)прод
где, ni и nj- количество вещества исходных веществ и продуктов реакции соответственно (численно равно коэффициенту в уравнении реакции), (моль).
ΔrS0298 – стандартная энтропия реакции, (Дж/К).
ΔfS0298 – стандартная энтропия образования химического вещества, (Дж/К*моль).
Знак « - » перед членом TΔS0298 (энтропийным членом) ставится, для того чтобы при ΔH=0 сделать ∆G отрицательной величиной ΔG<0 – условие самопроизвольного протекания реакции.
Если пренебречь изменением ΔS0 и ΔН0 с увеличением температуры, то можно определить Травн, т.е. температуру, при которой устанавливается химическое равновесие химической реакции для стандартного состояния реагентов, т.е. из условия равновесия реакции ΔG=0 имеем 0=ΔrH 0298– TΔrS 0298, отсюда
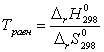
![]()
Следует знать:
Если ΔS=0 (ΔS>0), ΔH<0(ΔH=0) то ΔG <0 – реакция протекает самопроизвольно, процесс протекает в прямом направлении (энергетически выгоден).
Если ΔS=0(ΔS<0), ΔH>0 (ΔH=0) то ΔG>0 – протекание реакции невозможна, возможна только в обратном направлении (энергетически невыгоден).
Если ΔS=0, ΔH=0 ΔG=0 – система находится в состоянии равновесия.
Примеры решения задачПохожие работы
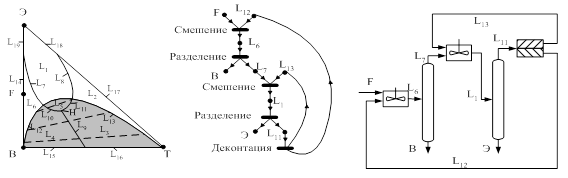
... принципа приближения и термодинамической обратимости к экстрактивной ректификации, с одной стороны, и выявить области оптимальности схем экстрактивной ректификации, с другой стороны. Постановка задачи Целью данной работы является разработка технологии разделения азеотропной смеси циклогексан – бензол – этилбензол методом экстрактивной ректификации, обладающей минимальными энергозатратами. Для ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...
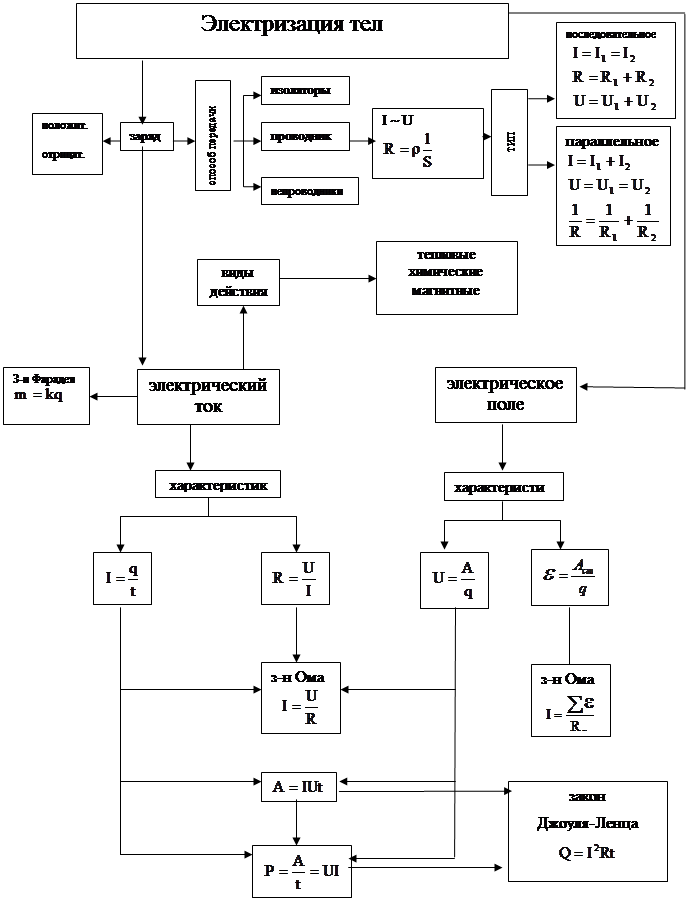
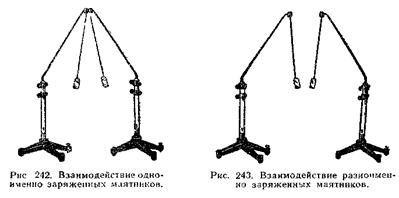
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
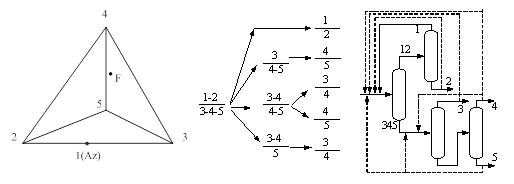

0 комментариев