Навигация
Реакция с родизонатом бария
3. Реакция с родизонатом бария.
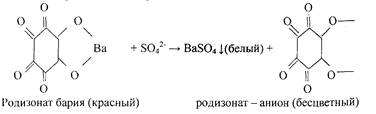
Методика. На листок фильтровальной бумаги наносят каплю раствора ВаС12 и 1 каплю раствора родизоната натрия Na2C6Oe или родизоновый кислоты Н2Сб06. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1-2 капли раствора, содержащего сульфат - ионы (Na2SO4, K2~SO4 или H2SO4 разбавленной). Пятно обесцвечивается.
Аналитические реакции сульфит- иона SО32-В водных растворах сульфит- ионы бесцветны, подвергаются гидролизу, являются сильными восстановителями (уже в водных растворах они медленно окисляются кислородом воздуха до сульфатов). Сульфит - ион обладает довольно эффективными комплексообразующими свойствами как лиганд.
Средние сульфиты натрия и калия хорошо растворяются в воде, средние сульфиты других металлов, как правило, малорастворимы в воде.
При действии кислот на сульфиты они разлагаются.
1. Реакция с хлоридом бария (фармакопейная).
Ва2++ SO32- —> ВаSО3|(белый кристаллический)
Аналогично протекает реакция сульфит- ионов и с хлоридом стронция SrCl2. Осадок растворяется в разбавленных НС1 и HNO3 с выделением газообразного диоксида серы SO2:
ВаSО3 + 2 НС1 = SO2 + ВаC12 + Н2О
2. Реакции с нитратом серебра
2 Ag+ + SO32- = Ag2SO3
Осадок растворяется при избытке сульфит-ионов с образованием комплексных дисульфитоаргентат (I) – ионов 2-[Ag(SO3)2]3-
Ag2SO3 + 3 SO32-— 2-[Ag(SO3)2]3- В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно темнеет, за счет выделения оксида серебра Ag2O:
Ag2SO3 -> Ag2O + SO2
3.Реакция разложения сульфитов кислотами (фармакопейная).
SQj2' + 2H+-+SO2T + H2O
Выделяющийся диоксид серы SO2 обнаруживают по характерному залаху, а также по обесцвечиванию водного раствора йода или перманганата калия:
SO2 + h + 2 Н2О -- H2SO4 + 2 HI
5 SO2 + 2 KMnO4 + 2 H2O -> K2SO4 + 2 MnSO4 + 2 H2SO4
Разложение сульфитов под действием кислот ускоряется при нагревании и при понижении рН среды.
4.Реакция с перманганатом калия.
5 SO32- + 2 МпО4- + 6 Н+ ->• 2 Мп2+ + 5 SO42' + 3 Н2О
В кислой среде сульфит - ионы окисляются до сульфат - ионов, при этом розовый раствор перманганата калия обесцвечивается.
В нейтральной среде сульфит - ион при реакции с МпО4' - ионом также окисляется до сульфат - иона, при этом кроме обесцвечивания образуется темный хлопьевидный осадок МпО(ОН)<
3 SO32- + 2 МпО4- + 3 Н2О — 2 МпО(ОН)2 + 3 SO42- + 2 ОН-
5.Реакция с раствором йода (фармакопейная).
SO32- +I2 (желто-бурый) + Н2О -> SO42' + 2 Г (бесцветный) + 2 Н+ Реакцию проводят в нейтральных или слабо кислых растворах.
6.Реакция восстановления сульфит - иона металлическим цинком в кислой среде.
SO32- + 2 НГ ->■ SO2 + Н2О SO2 + 3 Zn + 6Н+ -•• H2S + 3 Zn2+ + 2 Н2О
полоску фильтровальной бумаги, смоченной раствором соли свинца. Бумага чернеет:
H2S + Pb2+ — PbS + 2 Н+
7.Другие реакции сульфит - иона.
Сульфит - ион в растворах можно открыть также другими реакциями: с красителями (фуксин, малахитовый зеленый) - обесцвечивание красителя; С дихроматом калия - обесцвечивание раствора; с нитропруссидом натрия Na2[Fe(CN)5NO] - розово - красное окрашивание и др.
Аналитические реакции тиосульфат- иона S2O32-.
Тиосульфат - ион S2O32- - анион неустойчивой двухосновной тиосерной кислоты H2S2O3 средней силы, которая в водных растворах разлагается с выделением элементной серы:
H2S2O3 -> S + SO2 + Н2О
В водных растворах S2O32- - ион бесцветен, практически не гидролизуется, является сильным восстановителем и достаточно эффективным лигандом -комплексообразователем.
Тиосульфаты щелочных металлов, стронция, цинка, кадмия, железа (II), кобальта (II), никеля (II), марганца (II) растворимы в воде, а остальных металлов малорастворимы в воде.
1.Реакция с хлоридом бария.
_ Ва2++ S2O32- —♦ Ва S2О3 (белый мелкокристаллический) Осадок растворяется в кислотах с разложением:
BaS2O3 + 2 Н+ -> Ва2+ + S + S02 + Н20
2.Реакция разложения тиосульфатов кислотами (фармакопейная).
При действии минеральных кислот на тиосульфаты вначале образуется нестабильная тиосерная (серноватистая) кислота H?S2O3, быстро разлагающаяся с выделением газообразного диоксида серы S02 и элементной серы S, которая вызывает помутнение 'раствора:
SO32- + 2 Н+ <-> H,S,O3 H2S2O3 — SI + SO2T + H20
Выделяющийся SO2 обнаруживают либо по характерному запаху, либо по обесцвечиванию им растворов КМпО4 или йода. Раствор в первой пробирке мутнеет вследствие выделения серы. Раствор в пробирке - приемнике обесцвечивается.
3.Реакция с йодом.
2 S2O32- + I2 = S4O62- + 2 I-
Эта реакция имеет большое значение в количественном титриметричееком анализе. Разбавленный раствор йода, имеющей желтую окраску, и прибавляют по каплям раствор Na2S2O3 до обесцвечивания раствора йода.
4.Реакция с нитратом серебра (фармакопейная).
2 Ag+ + S2O32- -> Ag2S2O3 (белый)
Осадок Ag2S2O3 быстро разлагаются до черного Ag2S. Цвет осадка последовательно изменяется на желтый, бурый и под конец - на черный:
Ag2S2O3 + Н20 -> Ag2S + H2SO4
При избытке S2O32- - ионов осадок Ag2S2O3 растворяется с образованием комплексных дитиосульфатоаргентат (I) - ионов [Ag(S2O3)2]3-:
Ag,S2O3 + 3 S2O32- -- 2 [Ag(S2O3)2]3-
5.Реакция с сульфатом меди (II).
2Си2+ + 3 S2O32' -- Cu2S2O3 + S4O62- Cu2S2O3 + H20 -> Cu2SКчерный) + H2SO4
6.Другие реакции S2O32- - иона.
С FeCI3 образует тиосульфатный комплекс [Fe(S2O3)2]- - фиолетового цвета (постепенно разлагающийся в водном растворе), с солями ртути (II) - черный осадок сульфида ртути (II) HgS; легко окисляется различными окислителями (Н2О2, К2Сг207 и другие).
Аналитические реакции оксалат- иона С2О4
Оксалат- ион С2О42-- анион двухосновной щавелевой кислоты Н2С2О4 средней силы, сравнительно хорошо растворимой в воде. Оксалат- ион в водных растворах бесцветен, частично гидролизуется, сильный восстановитель, эффективный лиганд -образует устойчивые оксалатные комплексы с катионами многих металлов. Оксалаты щелочных металлов, магния и аммония растворяются в воде, а других металлов мало растворимы в воде.
1. Реакция с хлоридом бария
Ва2+ + С2О42- = ВаС2О4 (белый)
Осадок растворяется в минеральных кислотах и в уксусной кислоте (при кипячении).
2. Реакция с хлоридом кальция (фармакопейная):
Са2+ + С2О42- = СаС2О4 (белый)
Осадок растворяется в минеральных кислотах, но не растворяется в уксусной кислоте.
3. Реакция с нитратом серебра.
2 Ag+ + С2О42- —> Ag2C2O4.|.( творожистый)
Проба на растворимость. Осадок делят на 3 части:
а). В первую пробирку с осадком прибавляют по каплям при перемешивании раствор HNO3 до растворения осадка;
б). Во вторую пробирку с осадком прибавляют по каплям при перемешивании концентрированный раствор аммиака до растворения осадка; в). В третью пробирку с осадком прибавляют 4-5 капель раствора НС1; в пробирке остается белый осадок хлорида серебра:
Ag2C2O4 + 2 НС1 -> 2 АС1 (белый) + Н2С2О4
4.Реакция с перманганатом калия.
Оксалат ионы с КМпО4 в кислой среде окисляются с выделением СО2; раствор КМпО4 при этом обесцвечивается вследствие восстановления марганца (VII) до марганца (II):
5 С2О42- + 2 МпО4' + 16 Н+ ->• 10 СО2 + 2 Мп2+ + 8 Н2О
Разбавленный раствор КМпО4. Последний обесцвечивается; наблюдается выделение пузырьков газа - СО2.
Аналитические реакции карбонат - иона СО32-Карбонаты - соли нестабильной, очень слабой угольной кислоты Н2СО3, которая в свободном состоянии в водных растворах неустойчива и разлагается с выделением СО2:
Н2СО3 -- СО2 + Н2О
Карбонаты аммония, натрия, рубидия, цезия растворимы в воде. Карбонат лития в воде мало растворим. Карбонаты остальных металлов мало растворимы в воде. Гидрокарбонаты растворяются в воде. Карбонат - ионы в водных растворах бесцветны, подвергаются гидролизу. Водные растворы гидрокарбонатов щелочных металлов не окрашиваются при прибавлении к ним капли раствора фенолфталеина, что позволяет отличить растворы карбонатов от растворов гидрокарбонатов (фармакопейный тест).
1.Реакция с хлоридом бария.
Ва2+ + СОз2- —> ВаСО3 (белый мелкокристаллический)
Аналогичные осадки карбонатов дают катионы кальция (СаСО3) и стронция (SrCO3). Осадок растворяется в минеральных кислотах и в уксусной кислоте. В растворе H2SO4 образуется белый осадок BaSO4.
К осадку медленно, по каплям прибавляют раствор НС1 до полного растворения осадка:
ВаСОз + 2 НС1 ->• ВаС12+ СО2 + Н2О
2.Реакция с сульфатом магния (фармакопейная).
Mg2+ + СОз2- ->MgCO3 (белый)
Гидрокарбонат - ион НСО3- образует с сульфатом магния осадок MgCO3 только при кипячении:
Mg2+ + 2 НСОз- -> MgCO3 + СО2 + Н2О
Осадок MgCO3 растворяется в кислотах.
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
... имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) ...
... + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы. 9. Инструментальные методы анализа Инструментальные метода анализа обладают многими ...

0 комментариев