Навигация
Реакция с литизоном (дифенилтиокарбазоном). В растворах дитизона
5. Реакция с литизоном (дифенилтиокарбазоном). В растворах дитизона
устанавливается таутомерное равновесие между тионной и тиольной формами:
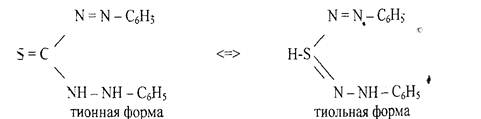
В результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:
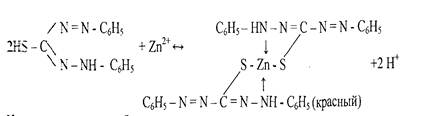
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекуле воды. 6. Реакция образования -зелени Ринмана-.
Zn(NO3)2+ Co(N03)2 —t-> CoZn02 (зеленый) + 4 NO2 +О2.
-Зелень Ринмана- - смешанный оксид кобальта и цинка CoZnO2 зеленого цвета.
Другие реакции катионов цинка.
Катионы Zn2+ при взаимодействии с различными другими реактивами образуют осадки: с Na2HPO4 - белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке); с К2Сг04 -желтый ZnCrO4 (растворяется в кислотах и щелочах); с СоС12 и (NH4)2[Hg (SCN)4] -голубой ZnCo[Hg (SCN)4]; а также с различными орг. реагентами.
Аналитические реакции катиона алюминия Al3+1. Реакция с щелочами:
А13+ + 3 ОН- -► А1(ОН)3 (белый)
А1(ОН)3 + 3 ОН- -> [А1(ОН)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4C1). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок А1(ОН)3:
[А1(ОН)6]3- + 3 NH4+ -> А1(ОН)3 + 3 NH3 + 3 Н2О
Наиболее полное осаждение гидроксида алюминия происходит при рН- 5-6. Осадок А1(ОН)3 растворяется в кислотах, но не растворяется в аммиаке.
2. Реакция с аммиаком.
А13+ + 3 NHrH2O -> А1(ОН)31 (белый аморфный) + 3 NH4+
3. Реакция с нитратом кобальта - образование -тенаровой сини- (фармакопейная).
-Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
2 A12(SO4)3 + 2 Co(NO3)2 —tT-> 2 Со(А1О2)2 + 4 NO2 + 6 SO3 + O2.
4. Реакция с алюминоном
Катионы А13+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для кратности NH4L) образуют в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состав A1(ОН)2 L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок. Мешают катионы Са2+, Cr3+, Fe3+
5. Реакция с ализарином (1,2 - диоксиантрахинон).
Катионы А13+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые -алюминиевыми лаками-.
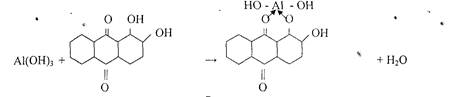
Комплекс устойчив в уксусной среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы: Zn2+, Sn(II), Cr3+, Mn2+, Fe3+ и др.
Другие реакции катиона алюминия А13+.
Катионы А13+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый А13РО4, с CH3COONa- белый СН3СООА1(ОН)2, с оксихинолином (кратко Нох) - желто-зеленый [А1(О)3] и др.
Аналитические реакции катиона олова (II)1. Реакция с щелочами: Sn2+ + 2 ОН- - Sn(OH)2 |(белый)
Sn(OH)2 + 2 ОН-= [Sn(OH)4]2'.
2. Реакция с аммиаком: Sn2+ + 2 NH3-H2O) — Sn(OH)2 (белый) + 2 NH4CI
Осадок не растворяется в избытке аммиака.
3. Реакция с сульфид - ионами:8Sn2+ + S2- — SnS . (бурый)
Осадок не растворяется в щелочах, в избытке раствора сульфида натрия..
4. Реакция с солями висмута (III).Олово (II) является хорошим восстановителем:
2 Bi3+ + 3 [Sn(OH)4]2- + 6 ОН- — 2 Bi + 3 [Sn(OH)6]2-
5. Реакция с хлоридом ртути(П): [SnCl4]2-+ 2 HgCI2 -+ Hg2Cl2 J. + [SnCl6]2-
Выпадает белый осадок каломели Hg2Cl2, который постепенно чернеет за счет выделяющейся металлической ртути: [SnCl4] -+ Hg2Cb —> 2 Hg + [SnCl6]
Другие реакции олова (II).
Соединения олова (II) при взаимодействии с молибдатом аммония образуют так называемую -молибденовую синь- (раствор окрашивается в синий цвет); с Na2HPO4 дают белый осадок Sri3(PO4)2 (растворяется в кислотах и щелочах); при реакции с FeCI3 восстанавливают железо (III) до железа (II), причем в присутствии гексацианоферрата (III) калия K3[Fe(CN)6] раствор сразу же окрашивается в синий цвет вследствие образования турибуллевой сини.
Аналитические реакции олова (IV)Олово (IV) обычно открывают, предварительно восстановив его металлическим железом, магнием, алюминием и т.д. до олова (II). Затем проводят реакции, характерные для олова (II), как описано в предыдущем разделе.
1. Реакция олова (IV), с щелочами:
Sn4+ + 4 ОН- = Sn(ОН)4 (белый)
Осадок растворяется в избытке р-ра щелочи с образованием гидрокомплексов.
Sn(ОН)4 + 2 ОН- =[Sn(ОН)6]2-
2. Реакция с сульфид ионами: Н2[SnCl6] + 2Н2S = Sn S2 (желтый) + 6 НCl
Выпадает желтый осадок сульфида олова (IV), который в отличие от сульфида олова (II), растворяется в избытке(NH4)2S или Nа2S с образованием тиосолей.
SnS2+ (NH4)2S = (NH4)2SnS3.
3. Реакция восстановления олова (IV) до олова (II):
[SnCl6]2-+ Fe -> [SnCl4]2-+Fe2++ 2 Cl-.
Олово (II). полученное после восстановления олова (IV), открывают реакциями с солями висмута (III), с хлоридом ртути (II).
Другие реакции олова (IV).
С рядом органических реагентов олово (IV) образует окрашенные или • малорастворимые комплексы. С хлоридами рубидия и цезия олово (IV) образует малораетворимые комплексные соли состава Rb2[SnCl6] и Cs2[SnCls].
Аналитические реакции мышьяка (III) и мышьяка (V)Мышьяк (III) и мышьяк (V) обычно открывают в виде арсенит - иона AsO33- и арсенат - ионов AsO3- соответственно, т.е. в форме анионов, а не в форме катионов. Поэтому реакшш этих анионов описаны при рассмотрении аналитических реакций анионов. Аналитические реакции катиона хрома (III) Cr3+.
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
... имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) ...
... + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы. 9. Инструментальные методы анализа Инструментальные метода анализа обладают многими ...

0 комментариев