Навигация
Другие реакции катионов кобальта (II)
9. Другие реакции катионов кобальта (II)
Катионы кобальта Со2+ с нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до Со3+) желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединение Со2+ с бурой Na2B4O710H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNHj - желто-бурый осадок комплексного соединения.
Аналитические реакции катиона никеля (II) Ni2+Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1.Реакция с щелочами.
Ni2+ + 2 ОН- -> Ni (ОН)2(зеленый)
Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака: Ni(OH)2 + 2 Н+ -• №2+ + 2 Н2О
Ni(OH)2 +6 NH3 — [Ni(NH3)6]2+ + 3 ОН-
2.Реакция с аммиаком.
Ni(NO3)2 + NH3H2O — NiOHNO3 + NH4NO3,
NiCl2 + NH3H2O -- NiOHCl + NH4C1 2NiSO4 + 2 NH3H2O -- Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) Добавляют концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 -> [Ni(NH3)6]2+ + ОН- + CY
Оксисоль Ni(II)гексамминникель (II) катион
Прибавляют к ней по каплям концентрированный раствор КВг до выпадения фиолетового осадка [Ni(NH3)6]Br2.
Комплексы [Ni(NH3)6]Ck [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
3.Реакция с реактивом Чугаева (диметилглиоксимом).
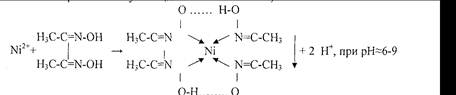
Розово-красный Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака. Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4.Реакция с сульфид - ионами. -
Ni2+ + S2- -> NiS (черный)
5.Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Ру) образуют голубой осадок-комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды - черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой -сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
Аналитические реакции катиона ртути (II) Hg2+
Ионы ртути (II) [Hg(H2O)2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
1.Реакция с щелочами (фармакопейная).
Hg2+ + 2 ОН- -> Hg О|(желтый) + Н2О
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2. HgCl2 и комплекса [Hgl4f:
HgO + 2 HNO3 — Hg(NO3)2 + H2O
HgO +2 Cl- + H2O - HgCl, + 2 OH-
HgO +4 Г + H2O - [Hgl4]2- + 2 OH-
2.Реакция с аммиаком.
HgCl2 + 2 NH3 — HgNH2CL6елый) + NH4C1 2 Hg(NO3)2 + 4 NH3 + H2O --[OHg2NH2]NO3 (белый) + 3 NH4NO3
Осадки растворяются (лучше - при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона гетрамминртути (II) [Hg(NH3)4]2+.
1 После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4C1 или NH4NO3) и по каплям - водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ -+ [Hg(NH3)4]2+ + СГ |OHg2NH,]NO2 + 4 NH3 +3 NH4+ — 2 [Hg(NH3)4]2+ +NO3- + H2O
3.Реакция с иодидом калия (фармакопейная).
Hg2+ + 2 Г ■— Hgbi(KpacHufi) Hgl2 + 21-^ [Hgl4]2- (бесцветный)
Доведению реакции мешают катионы Pb2+, Cu2+, Ag+, Bi(III), а также окислители. Капельный метод рекомендуется для открытия Hg2+ даже в присутствии мешающих катионов.
4.Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто - красную и бурую на коричнево-черную при избытке сульфид - ионов.
3 HgCl, + 2 H2S — 2 HgSHgCl2 + 4 НС1
2 HgS-HgCl2 + H2S •— 3 HgS (коричнево-черный) + 2 HC1
Аналогично протекают реакции HgCl2 с сульфидом натрия Na2S.
Выпадает белый осадок, чернеющий при дальнейшем прибавлении Na2S или HgS, H2S не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь НС1 + НNО3)
3 HgS +6 HC1 + 2 HNO3 — 3 HgCl2 + 2 NO + 3S + 4 H2O
5.Реакция с хлоридом олова (II).
Катионы Hg2+ восстанавливается олово (II) вначале до Hg22+, а затем - до металлической ртути Hg°.
2 Hg2+ + [SnCl4]2- + 4 СГ — Нё2С12|(белый) + [SnCl6f - Hg2Cl2 + [SnCl4f — 2 Hg° (темный) + [SnCl6f Выпадает белый осадок Hg2Cl2, который постепенно'темнеет.- Проведению реакции мешают катионы Ag2+, Hg22, Sb(III), Bi(III). t
6.Реакция с металлической медью.
Катионы Hg2+ восстанавливаются металлической медью до металлической ртути. Hg2+ + Си0 -> Hg° (темный) + Си2+
Методика. На медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
7.Реакция с хромат - ионами.
Hg2+ + СгО42' —>СгО4(желтый)
8.Другие реакции катионов ртути (II).
Катионы Hg2+ с ортофосфат - ионами образуют белый осадок Hg3(PO4)2; с дифенилкарбазидом и дифенилкарбазоном - комплекс сине-фиолетового цвета; с дитизоном - желто-оранжевый или красный комплекс, в зависимости от условий проведения реакции.
Аналитические реакции анионов первой аналитической группы: SO42-, SO32-, S2O32-, С2О42-, СО32-, В4О72-(ВО2), РО43-, AsO43-, АsОз3-, F-Групповой реагент - водный раствор ВаС12. Реакции с групповым реагентом проводят в нейтральной или слабо щелочной среде, так как осадки соответствующих бариевых солей малорастворимы в данных условиях. Осадки бариевых солей анионов I группы растворяются в минеральных кислотах, за исключением BaSO4.
Карбонат ВаСО3, тетраборат ВаВ4О7, ортофосфат Ва(РО4)2 и арсенат Ba3(As04)2 растворимы и в уксусной кислоте.
Катионы Ag+ дают осадки солей серебра с анионами I группы, за исключением фторид - аниона F, поскольку AgF растворим в воде. Эти осадки растворяются в азотнокислом растворе, в отличие от солей серебра анионов второй аналитической группы.
Соли свинца анионов I группы также нерастворимы в воде, за исключением тетрабората (В4О72-) и периодата.
Анионы I группы в водных растворах бесцветны. Анионы - окислители - AsO43-, иногда СгО42~. Сг2О72\ Анионы - восстановители - AsO43-, S2O32-, SO32-, C2O42\
Под действием минеральных кислот анионы -летучих- кислот (СО32\ SO32- и S2O32-) разрушаются с выделением газообразных СО2 или SO2
Аналитические реакции сульфат-иона SO42-Сульфаты аммония и многих металлов хорошо растворяются в Н2О. Сульфаты кальция, стронция, бария, свинца (II) малорастворимы в воде, что широко используется в химическом анализе.
1.Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- —> BaSO4 (белый мелкокристаллический)
Выпадает белый осадок сульфата бария. Если в растворе присутствует перманганат калия КМО4, то осадок BaSO4 окрашивается в фиолетово - красный цвет за счет адсорбции МпО4' - ионов на осадке.
BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4->Ba(HSO4)2
2.Реакция с катионами свинца.
РЬ2т + SO42- -> PbSO4J. (белый кристаллический)
Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений:
PbSO4 + 4 NaOH -- Na2[Pb(OH)4] + Na2SO4
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
... имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) ...
... + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы. 9. Инструментальные методы анализа Инструментальные метода анализа обладают многими ...

0 комментариев