Навигация
Другие реакции цианид-ионов
4. Другие реакции цианид-ионов.
Цианид – ион образует многочисленные устойчивые комплексы с солями различных металлов: а) Буро-черный CuS растворяется в присутствии CN- - ионов с образованием бесцветных цианидных комплексов меди (1) — тетерациано - купрат (1) - ионов [Cu(CN)4]3- Эту реакцию проводят капельным методом на фильтровальной бумаге. Для этого фильтровальную бумагу смачивают аммиачным раствором сульфата меди (II), слегка высушивают и вносят в пары сероводорода. Бумага темнеет вследствие образования сульфида меди (II) CuS. На бумагу наносят 1-2 капли раствора, содержащего цианид - ионы.
Цианид - ионы реагируют с пикриновой кислотой с образованием продуктов реакции, красного цвета; с ацетатом меди (II) и бензидином дают продукты синего цвета.
Аналитические реакции тиоиианат - иона (роданид - иона) SCN-SCN- - ион - анион сильной роданистоводородной кислоты HSCN. Тиоцианат - ион в водных растворах бесцветен, не гидролизуется, обладает окислительно - восстановительными свойствами, с солями различных металлов образует устойчивые тиоцианатные комплексы, например, [Co(NCS)4]2-, [Fe (NCS)]3- и т.д.
Тиоцианаты щелочных и большинства других металлов хорошо растворяются в воде, за исключением тиоцианатов меди (II) Cu(SCN)2, меди (I) CuSCN, серебра (I) AgSCN, ртути (II) Hg(SCN)2, свинца (II) Pb(SCN)2, таллия (I) T1SCN, которые мало растворимы в воде.
1. Реакция с нитратом серебра.
SCN- + Ag+ = AgSCN (белый творожистый)
Проба на растворимость. Осадок AgSCN нерастворим в минеральных кислотах и в растворе карбоната аммония. Растворяется в водном аммиаке, в растворах тиосульфата натрия, цианида калия, при избытке тиоцианат - ионов с образованием соответствующих растворимых комплексов серебра:
AgSCN + 2 NH3 — [Ag(NH3)2]+ + SCN-
AgSCN +nS2O32-= [Ag(S2O3)n]1-2n + SCN- (n= 2 и 3)
AgSCN +2 CN- = [Ag(CN)2]- + SCN'
AgSCN + (n-1) SCN- -> [Ag(SCN)n]'-n (n=3 и 4)
2.Реакция с солями кобальта (II).
4 NCS' + Со2+ <-> [Co(NCS)4]2-
тетратиоцианатокобальтат (II) - ион (синий)
Эти комплексы недостаточно прочны, при не очень большом избытке ионов NCS' равновесие смещено влево и раствор окрашивается не в синий, а в розовый цвет (окраска автокомплексов кобальта (II)). Для смещения равновесия вправо реакцию проводят в водно - ацетоновой среде или же экстрагируют комплекс органическими растворителями, в которых он растворяется лучше, чем в воде (например, в смеси изоамилового спирта и диэтилового эфира). При этом тетратиоиианатный комплекс кобальта (II) переходит в органическую фазу и окрашивает ее в синий цвет. Проведению реакции мешают катионы железа (III) Fe3+, меди (II) Си- , также образующие окрашенные соединения с тиоцианат - ионами - желто-бурый комплекс меди (II) и красные комплексы железа (III). Мешающее действие этих катионов можно устранить, восстановив их SnCl2 до Fe2+ и Си+ или связывая их в устойчивые бесцветные комплексы маскирующими агентами (фторид (NaF) — и тартрат (NaKC4H4O6)- анионы, а также оксалат и ортофосфат - ионы.
3.Реакция с солями железа (III).
Тиоцианат- ионы образуют с катионами железа (III) в кислой (для подавления гидролиза железа (III)) среде тиоцианатные комплексы железа (III) красного цвета состава [FefNCS)n(H2O)6.n]3--, где п=1,2.,.,6.
4.Реакция с иодат - ионами. -
В кислой среде тиоцианат - ионы окисляются иодат - ионами с выделением свободного йода:
5SCN- + 6 Юз' + Н+ + 2 Н2О -> 5 SO42' + 5 HCN + ЗЬ
Методика. Фильтровальную бумагу смачивают свежеприготовленным раствором крахмала и высушивают. Получают крахмдльную бумагу. На нее наносят кашпо разбавленного раствора НС1, каплю раствора KNCS и каплю раствора иодата калия , КЮз. Бумага окрашивается в синий цвет вследствие образования синего молекулярного комплекса крахмала с йодом, выделяющимся в процессе реакции.
5.Другие реакции тиоцианат - ионов.
С нитратом ртути (II) Hg(NO3)2 они образуют белый осадок тиоцианата ртути (II) Hg(SCN)2, растворимый при избытке SCN- - ионов; с катионами Си-' - растворимые комплексы изумрудно - зеленого цвета или (при избытке катионов Си2+)черный осадок тиоцианата меди (II) Cu(SCN)2, который при нагревании превращается в белый тиоцианат меди (I) СиЗСЫ.Тиоцианат — ионы разлагаются растворами H2SO4,1INO3 и сильных окислителей, вступают в многочисленные реакции комплексообразоваиия, осаждения и т.д.
Аналитические реакции сульфид - иона S2-Сульфид - ион S2- - бесцветный анион очень слабой двухосновной сероводородной кислоты H2S. В водных растворах сульфид — ион подвергается глубокому гидролизу, не склонен к образованию комплексов металлов. Средние сульфиды аммония, щелочных и щелочно - земельных металлов хорошо растворяется в воде, а остальные сульфиды мало растворимы в воде. Кислые гидросульфиды, содержащие гидросульфид - анион HS- хорошо растворяются в воде.
Сероводородная вода (раствор H2S в воде) окисляется кислородом воздуха с выделением элементной серы:
2 H2S + О2 -> S + 2 Н2О (вода мутнеет)
Сероводород H2S - весьма ядовит. Работать с сероводородной водой необходимо только под тягой!
1.Реакция с нитратом серебра.
S2- + 2 Ag+= Ag2S (черный)
Осадок Ag2S не растворяется в водном аммиаке, растворим в разбавленной азотной кислоте при нагревании с выделением элементной серы:
Ag2S + 4 HNO3 -> S + 2 NO2 + 2 AgNO3 + 2 Н2О
2.Реакция с сильными кислотами.
S2- + 2H+=H2St
При избытке ионов водорода равновесие смещается вправо и образующийся сероводород удаляется из сферы реакции. Ощущается характерный запах сероводорода. К отверстию пробирки подносят фильтровальную бумагу, пропитанную раствором ацетата свинца. Бумага чернеет вследствие выделения черного сульфида свинца: H,S + (СН3СОО)2РЬ -> PbS + 2 СН3СООН
3.Реакция с катионами кадмия.
S2- + Cd2+ = CdS (желтый)
Реакцию проводят в кислых и нейтральных растворах.
4.Реакция с нитропруссидом натрия.
S2- + [Fe(CN)5NO]2- -->■ [Fe(CN)5NOS]4-
Фиолетовый комплекс
5.Другие реакции сульфид - иона.
Образует малорастворимые сульфиды с катионами ряда металлов, обесцвечивает кислый раствор КМпО4 и раствор йода с выделением серы - и т.д.
Аналитические реакции анионов третьей аналитической группы: NO2-, NO3-, СН3СОО-; и некоторых органических анионов: тартрат-, цитрат-, бензоат- и салицилат- ионовГруппового реагента не имеется.
Аналитические реакции нитрит - иона NO2-.
Нитрит - ион - анион очень слабой одноосновной азотистой кислоты HNO2, которая в водных растворах при обычных температурах неустойчива и легко разлагается по схеме:
2 HNO2 = N2O3 + Н20
N2O3 = NO + NO2
В водных растворах гидролизуется; редокс — амфотерен. Нитриты хорошо растворяются в воде (нитрит серебра AgNO2 - при нагревании). Нитрит - ион образует комплексы со многими металлами. Некоторые из этих координационных соединений, в отличие от -простых- нитритов, мало растворимы в воде, например, гексанитрокобальтаты (III) калия K3[Co(NO2)6] и аммония (NH4)3[Co(NO2)6], что используют в качественном анализе. Нитриты токсичны!
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
... имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) ...
... + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы. 9. Инструментальные методы анализа Инструментальные метода анализа обладают многими ...
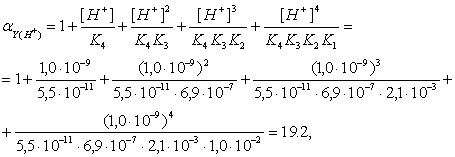
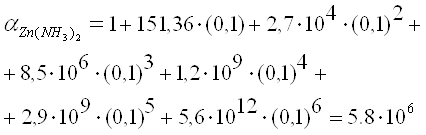

0 комментариев