Навигация
Реакция с купроном (1-бензоиноксимом)
5. Реакция с купроном (1-бензоиноксимом).
С6Н5 - СН - ОН
I СМ, - С = NOH
Cu2+ + H2L + 2 Н2О — СиЦН2О)21(зеленый хлопьевидный ) + 2 Н+
Реакцию проводят в аммиачной среде. Осадок не растворяется в избытке аммиака.
6.Реакция восстановления меди (II) металлами до металлической меди (фармакопейная).Реакцию дают металлы, расположенные в ряду напряжений металлов левее меди.
Cu2+ + Zn -- Си + Zn2+
Си2+ + Fe -> Си + Fe2+
3 Си2+ +2 А1 -► 3 Си +2 А13+
7.Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
8.Реакция с тиоцианат - ионами.
Си2+ + 2 SCN- — Cu(SCN)2J-+ CuSCN| + SCN- Образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN.
9.Другие реакции меди (II).
Катионы Си + с сульфид -ионами дают черный осадок сульфида меди CuS; с фосфатами - голубой осадок Си3(РО4)2. Известны реакции комплексообразования меди (II) с различными органическими реагентами - купроином, купфероном, дитиоксамидом и др.
Аналитические реакции катиона кадмия Cd2 . Акво ионы кадмия [Cd(H2O),,]-+ в водных растворах бесцветны.
1.Реакция с щелочами и аммиаком.
Cd2+ + 2 ОН- -> Cd(OH)2i(6enbrii)
Осадок Cd(OH)2 нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+: Cd(OH)2 + 4 NH3 --[Cd(NH3)4]2+ + 2 ОН- Осадок Cd(OH)2 растворяется в кислотах:
Cd(OH)2 + 2 Н3О+ — [Cd(H2O)4]2+
2.Реакция с сульфид - ионами.
Cd2+ + S2- -> CdS |(желтый)
Осадок CdS не растворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]--:
CdS + 4 Cl- -> [CdCl4]2- + S2-
CdS нерастворим в кислотах, за исключением НС1, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + НС1 -> H2[CdCl4] +H2S
3.Реакция с тетраиодовисмутатом (III) калия.
Cd2++ 2 [Bil4]- -> Cdl, + 3BiI3 |(черный)
4.Реакция с тетрароданомеркуратом (II) аммония.
Cd2+-+ [Hg(SCN)4]2- -> Cd[Hg(SCN)4] ()бразование бесцветных продолговатых кристаллов тетрароданомеркурата кадмия
Аналитически реакции катионов VI аналитической группы по кислотно-основной классификации: Cu2+, Hg2+, Cd2+, Co2+, Ni2+ Групповой реагент – NH4OH в избыткеХотя элементы расположены в разных груупах периодической системы Д.Ию Менделеева, все эти катионы характеризуются способностью комплексообразованию. Их гидроксиды растворяются в избытке аммиака с образованием комплексов различного состава. Растворы солей меди, кобальта и никеля окрашены; кадмия и ртути (II) бесцветны.
Аналитические реакции катиона меди (II) Си2+.Акво - ионы меди (II) [Си(Н2О)п]2+ окрашены в голубой цвет, поэтому растворы солей меди (II) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво - ионы меди (II) частично гидролизуются с образованием растворимых гидроксо-аквокомплексов состава [Cu(H2O)n.m(OH)m]2-m по схеме:
[Cu(H2O)]2+ + mH2O = [Cu(H2O)n.m(OH)m] m + тН3О+
1.Реакция с щелочами.
Си2++ 2 ОН-— Си(ОН)2 (сине-зеленый)
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка. Си(ОН)2 разлагается, теряя воду и образуется черный осадок оксида меди (II) СuО: Сu (ОН)2 — СuО (черный) + Н2О
Осадок Сu (ОН)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4] + синего цвета), комплексообразующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплексов меди (II).
2.Реакция с аммиаком (фармакопейная).
СuСЬ + NHrH2O — Си(ОН)С1 |(сине-зеленый) В избытке аммиака осадок растворяется с образованием ярко синего раствора:
Сu (ОН)С1 + 4 NH3-H2O — [Cu(NH3)4]2+ + ОН- + СГ + 4 Н2О В кислой среде комплексный тетрамминмедь (II) - катион разрушается:
[Си(Ш3)4]2+(ярко - синий) + 4 Н3О+ — [Сu (Н2О)4]2+(голубой) + 4 NH4+ и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди (II)). К аммиачному комплексу меди (II) прибавляют по каплям разбавленный раствор одной из кислот - НС1, HNO3 или H2SO4. Окраска раствора из ярко - синей переходит в голубую. Мешают катионы Со2+, Ni2+, олово (II).
3.Реакция с гексацианоферратом (II) калия.
2Cu2+ + [Fe(CN)6]4- — Си2[Ре(СЫ)6]|(красно-коричневый).
Капельный метод на фильтровальной бумаге: на лист фильтровальной бумаги, пропитанной раствором ферроцианида калия, наносят каплю раствора соли меди (II). На бумаге образуется красно-коричневое пятно.
Осадок не растворяется в разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu,[Fe(CN)6] + 12 NH3+ 4 Н2О — ( NH4)4[Fe(CN)6] + 2 [Cu(NH3)4](OH)2 Проведению реакции мешают катионы, также образующие окрашенные осадки .и ферроцианидов (Fe3+, Со2т, Ni2+).
4.Реакция с тиосульфатом натрия.
2Си2+ + 2 82О32Хиз6ыток) + 2 Н2О — Cu2S |(темно-бурый) + §j +4 H++~2SO42~
Выпадает темный осадок, содержащий смесь Cu:S и S.
5. Реакция с купроном (1-бензоиноксимом).
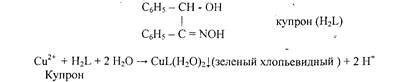
Реакцию проводят в аммиачной среде. Осадок не растворяется в избытке аммиака.
6. Реакция восстановления меди (II) металлами до металлической меди (фармакопейная).Реакцию дают металлы, расположенные в ряду напряжений металлов левее меди.
Cu2+ + Zn -- Си + Zn2+
Си2+ + Fe -> Си + Fe2+
3 Си2+ +2 А1 -► 3 Си +2 А13+
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
... имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) ...
... + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы. 9. Инструментальные методы анализа Инструментальные метода анализа обладают многими ...
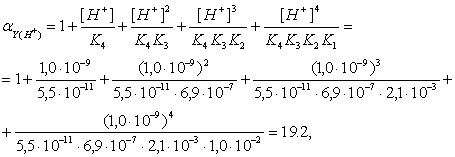
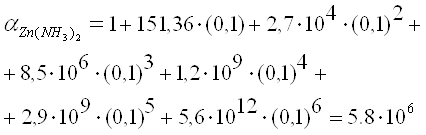

0 комментариев