Навигация
Оптические методы анализа
3. Оптические методы анализа
Оптические методы аналитического контроля относятся к группе спектрометрических методов (см. тему 1). Они основаны на использовании известных законов распространения света – поглощения, рассеяния, свечения, преломления. Явления и эффекты, возникающие при взаимодействии анализируемого вещества, и электромагнитного излучения регистрируются электронными оптическими приборами – спектрофотометрами, фотоколориметрами, нефелометрами, флуориметрами, рефрактометрами, поляриметрами.
С помощью оптических методов определяются в лабораториях и контролируются на технологических линиях концентрации растворов различных веществ.
3.1 Общие сведения о спектроскопии
В основе спектроскопии лежит явление испускания электромагнитного излучения атомами или молекулами определяемого вещества.
Спектр электромагнитного излучения в зависимости от длины волн делят на ультрофиолетовую-180-400 нм (1 нанометр=10-9м), видимую-400-700нм, ближнюю инфрокрасную-700-1100нм области.
Электромагнитное излучение - свет - имеет двойственную природу - волновую и корпускулярную (волна - частица) и для его описания используют два вида характеристик - волновые и квантовые.
К волновым характеристикам относятся частота колебаний, длина волны, волновое число, а к квантовой характеристике относится энергия квантов,
Частота колебаний - ν - показывает число колебаний электромагнитного излучения (света) в 1 секунду, измеряется в с-1.
Длина волны λ - это путь, который проходит волной за время полного периода колебаний.
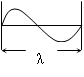
Длина волны измеряется в метрах и его долях: сантиметрах – см; миллиметрах-мм; микронах-μ; миллимикронах – mμ; наномикронах - нμ (1нм =10-9 м = 10-7 см = 10-6 мм). Например, зеленый свет представляет собой электромагнитные излучения с длиной волны λ == 500 - 550 нм или 5,0 · 10 -5 - 5,5 · 10 -6 см.
Частота колебаний и длина волны связаны между собой выражением 3.1;
![]() (3.1)
(3.1)
где: С - скорость света = 3 · 108 м/с = 3 · 1010 см/с
Величина, обратная длине волны называется волновым числом – ν и может быть рассчитана по выражению 3.2.
![]() (3.2)
(3.2)
Для зеленого света волновое число составит
![]()
Если скорость света выражена в см/сек, длина волна в см - то частота колебаний будет выражена в герцах — Гц.
Для зеленого света: ![]()
![]()
Энергия электромагнитного излучения определяется по выражению 3.3
E = h · ν , (3.3)
где h - постоянная Планка, равная 6,62 · 10-34 Дж с
3.2 Атомные спектры
Испускание света атомами происходит, за счет изменения энергии атомов. Атомы могут обладать только строго дискретными запасами внутренней энергии: Е0, Е1, Е2 и т.д., т.е. атомы не могут иметь энергию, промежуточную между Е0 и Е1 или между Е1 и Е2. В невозбужденном, т. е. нормальном состоянии атомы обладают минимальной энергией Е0. При подведении энергии, достаточной для возбуждения атома — электроны атома переходят на более высокий энергетический уровень Е1, Е2 и т.д. и через очень короткое время ~ 10-8 с они самопроизвольно возвращаются в нормальное состояние и освобождающая при этом энергия излучается в виде светового кванта hν.
Совокупность излучаемых частот связана с энергетическими состояниями атома. Чем меньше длина волны, тем больше волновое число или частота, тем больше энергия электромагнитного излучения.
Наблюдаемые в природе электромагнитные излучения охватывают диапазон волн от десятков километров до тысячных долей ангстрема, распределение энергий излучения по длинам волн представляет спектр, который подразделяется на ряд областей, при взаимодействии с веществом излучение каждой области изменяет состояние молекулы по-разному. Это объясняется тем, что волны разных областей спектра имеют разную энергию, эта энергия действует на атом или молекулу, находящуюся в нормальном, невозбужденном состоянии и возбуждают их.
Характер спектров, наблюдаемых при взаимодействии электромагнитного излучения и строением энергетических уровней атомов и молекул исследуемых веществ, различен.
Основными характеристиками спектров является положение линий или полос, в шкале длин волн, а также их форма и интенсивность.
Положение спектральных линий и полос зависит от расстояния между энергетическими уровнями, переходы между этими уровнями обуславливают эти линии и полосы.
Строение энергетических уровней является индивидуальной характеристикой молекул (атомов, ионов) данного вещества, поэтому по положению тех или иных линий и полос в спектре можно судить о природе вещества, взаимодействующего с излучением.
Интенсивность спектральных линий и полос определяется тем, сколько квантов излучения данной частоты поглощается, испускается или рассеивается веществом в единицу времени, т.е. сколько молекул вещества участвуют в данном квантовом переходе. Это позволяет проводить количественные определения различных веществ по интенсивности линий и полос спектра.
Таким образом, действуя на вещество электромагнитным излучением, обладающим достаточной энергией, способной возбудить атомы - можно получить через короткий промежуток времени излучение в виде светового кванта hv (ΔЕ = hν )
Каждая спектральная линия отражает переход с одного энергетического уровня на другой.
Наиболее яркой в спектре будет линия, отвечающая переходу с первого возбужденного уровня на основной уровень. Линия, отвечающая этому переходу, называется резонансной. Например, у натрия
11Na Is22s22p63s1
| ↓ | |||||
| ↑ ↓ | ↓ ↑ | ↓ ↑ | ↓ ↑ | ||
| ↑ ↓ |
При возбуждении атома натрия (нагревании, облучении и т.д.) валентный электрон (3s1) может переходить на уровни р и d, находиться на них очень короткое время и возвращаться вновь на основной. Этим переходам отвечают линии с длиной волны 588, 996 и 589, 593 нм. Это излучение окрашивает пламя в желтый цвет при введении солей натрия в пламя.
Это свойство атомов и ионов излучать свет в газообразном состоянии положено в основу методов эмиссионного и спектрального, где анализ основан на измерении длины волны, интенсивности и других характеристик излучений, испускаемых атомами за счет изменения их энергии.
Совокупность пространственно разделенных линий называют спектром.
Спектр, излучаемый раскаленными газами и парами, называется линейчатым или прерывистым, а спектр, который испускают раскаленные жидкие и твердые тела - сплошной.
Линейчатый спектр каждого элемента содержит ряд спектральных линий, соответствующих испускаемым лучам, характеризующихся определенной длиной волны λ или частотой колебания ν.
Наличие в спектре излучения таких линий дает возможность судить о наличии искомых элементов в исследуемом веществе, а интенсивность этих линий характеризует их количественное содержание. Цвет испускаемого или поглощаемого света зависит от длины волны. Например, наибольшая длина волны видимого света соответствует красному, а наименьшая – фиолетовому свету.
При проведении качественного спектрального анализа пользуются атласом спектральных линий.
В количественном анализе рассматривается связь между интенсивностью спектральной линии и концентрацией элемента в пробе.
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев