Навигация
R — сопротивление - ом
1 R — сопротивление - ом
W = —— W — электропроводность – ом -1
R
Сопротивление раствора электролита пропорционально растоянию между погружёнными в него электродами – ℓ и обратно пропорционально их площади – S
ℓ ℓ — расстояние между электродами (см)
R = ρ —— S — площадь электродов (см2)
S ρ — коэффициент пропорциональности
Если ℓ = 1 см
S = 1 cм2, то R = ρ
ρ — удельное сопротивление столба жидкости высотой 1 см и площадью 1 см2, т.е. сопротивление 1 см3.
Удельная электропроводность Нкаппа величина, обратная удельному сопротивлению
ℓ
Н = ——
ρ
Электропроводность раствора определяется, в основном, подвижностью (скоростью) ионов электролита и количеством переносимых ими зарядов, зависит от температуры и природы растворителя.
α — степень диссоциации электролита
x = α · c · F (z+u+ + z –u -) с — концентрация электролита экв/л
u+u - — скорости движения ионов F — число Фарадея
z+z - — заряды катиона и аниона ( при напряжённости электрического поля 1 в/см)
Удобнее пользоваться эквивалентной электропроводностью (она отнесена к количеству вещества).
λ — эквивалентная электропроводность — электропроводность объёма раствора, помещённого между двумя параллельными электродами, расположенными на расстоянии 1 см, который содержит 1 грамм-эвивалент растворённого вещества.
с — концентрация электролита ![]()
![]() — количество г/экв в 1 см3
— количество г/экв в 1 см3
Удельная и эквивалентная электропроводность связаны соотношением:
λ = ![]()
Измеряемым аналитическим сигналом в кондуктометрии является электропроводность, по мере концентрации раствора электролита — увеличивается число ионов-переносчиков электрического тока, и удельная электропроводность раствора увеличивается.
Однако, после определённого максимального значения удельная электропроводность начинает уменьшаться (у сильных электролитов увеличивается тормозящее действие со стороны молекул растворителя и со стороны противоположно заряженных ионов, а у слабых электролитов уменьшается степень их диссоциации).
Электропроводность бесконечно разбавленного раствора λ∞ определяется подвижностью ионов λ∞- и λ∞+ (без учёта тормозящего эффекта — релаксационного и электрофоретического).
Кондуктометрический метод подразделяется на прямую и косвенную кондуктометрию, к косвенной кондуктометрии относится кондуктометрическое титрование, в том числе и высокочастотное.
а) Прямая кондуктометрия — метод анализа, в основе которого лежит возможность определения концентрации раствора и электропроводности, т.к. между этими величинами существует определённая зависимость.
Прямая кондуктометрия — определение электропроводности — один из методов контроля вод, грунта, пищевых продуктов и т.д.
Этот метод лежит в основе многих приборов химического контроля.
При кондуктометрическом определении газов СО2, СО, NH3, H2S и др. — измерению электропроводности предшествует химическая реакция. При определении СО2 электропроводность щелочи измеряется после поглощения им СО2.
Используя серию стандартных растворов — строят градуировочный график зависимости (x, λ — c), затем измеряют хх или λханализируемого раствора и по градуировочному графику определяют его концентрацию — сх
4.1.2 Кондуктометрическое титрование
Основано на использовании химической реакции в результате которой происходит заметное изменение электропроводности раствора, при этом могут быть использованы химические реакции всех типов — нейтрализации, осаждения, комплексообразования, окисления-восстановления и т.д.
По ходу титрования замеряют электропроводность после добавления каждой порции рабочего раствора. Зависимость электропроводности анализируемого раствора изображают графически и получают кривую кондуктометрического титрования, имеющую излом, соответствующий точке эквивалентности, по точке эквивалентности находят объём раствора, пошедший на титрование, провести расчёт.
Qв-ва = Т · Vэкв. или Q =![]()
![]() Н
Н
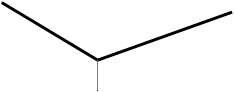
т.э.
![]() Vэкв. V
Vэкв. V
При кондуктометрическом титровании обязательно учитывать эффект разбавления, чтоб получить чёткий излом на кривой титрования — исследуемый раствор в электролитической ячейке должен быть разбавленным, а рабочий раствор в бюретке должен быть концентрированным, в соотношении 1 : 10.
При кондуктометрическом титровании для получения кривой титрования с резким изломом необходимо правильно подобрать рабочий раствор для титрования, растворитель для анализируемого вещества, правильно соотнести концентрации исследуемого раствора в электролитической ячейке и рабочего — в микробюретке.
Главное достоинство кондуктометрического титрования
— возможность фиксировать эквивалентную точку в окрашенных и мутных растворах.
— позволяет проводить анализы автоматически, дистанционно.
а) Графики кривых кондуктометрического титрования.
1. Метод нейтрализации:
а) H+Cl - + K+OH - → KCl + H2O
λH+ = 350
λOH- = 19,8
λCl- = 7,6
λK+ = 63,9
Более подвижный ион Н+ замещается менее подвижным ионом К+ после т.э. — появляется избыток ОН -, более подвижный чем К+.
![]() λ
λ
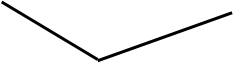
![]()
т.э.
![]()
Vэкв. V
б) CH3COOH + KOH → KCH3COO + H2O
λH+ = 350
λOH- = 19,8
λCH3COO- = 40,9
λK+ = 63,9
Слабая СН3СООН — плохо диссоциируется, образование более сильного электролита СН3СООН ведёт к повышению электропроводности, резко увеличивающейся при изгибе К+ и ОН –

![]() λ
λ
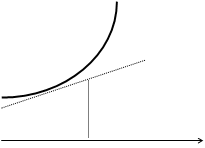
т.э. V
в) СН3СООН + NH4OH → NH4CH3COO + H2O
λH+ = 350
λCH3COO- = 40,9
λNH4- =73,5
λOH+ = 19,8
Вначале электропроводность низкая, обусловленная слабой диссоциацией СН3СООН, затем немного увеличивается за счёт образования сильного электролита NH4CH3COO после точки эквивалентности электропроводность остаётся постоянной, это обусловлено наличием сильного электролита NH4CH3COO, концентрация которого const.
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев