Навигация
Молярный коэффициент светопоглощения
3.5.2 Молярный коэффициент светопоглощения
Молярный коэффициент светопоглощения отражает индивидуальные свойства вещества (окрашенного) и является их характеристикой. Для разных веществ он имеет различную величину. У слабоокрашенных веществ (например, хромат калия) молярный коэффициент светопоглощения составляет 400 – 500, а у сильноокрашенных (например, дитизонат цинка) - 94 000.
Следует иметь в виду, что значение молярного коэффициента поглощения, как правило, не превышает значения 100 000 – 120 000 для наиболее интенсивно окрашенных соединений. Его значение определяется экспериментально спектрофотометрическими методами.
Молярный коэффициент светопоглощения является характеристикой чувствительности фотометрических реакций, чем больше его величина, тем чувствительнее и точнее определение. При выборе реактивов, дающих цветовую реакцию с определяемым веществом, выбирают тот, который образует соединения с максимальным коэффициентом светопоглощения.
Из закона Бугера–Ламберта–Бера вытекают два вывода, которые имеют практическое значение.
Первый вывод. При одинаковой интенсивности окраски одного и того же вещества их концентрации обратно пропорциональны толщине поглощающих слоёв.
Доказательство. Предположим, что имеются два раствора одного и того же вещества, но с разной концентрацией. Согласно закону Бугера-Ламберта-Бера (см. выражение 3.11) оптическая плотность (Д) каждого раствора может быть представлена следующими математическими выражениями:
ℓg![]() = εL1C1 ℓg
= εL1C1 ℓg![]() = εL2C2
= εL2C2
Принимая во внимание, что исследуемые растворы одинаково освещены, т. е. на них воздействует световой поток интенсивностью равной J0. Выравнивание световых потоков (J1 = J2), прошедших через растворы может быть достигнуто подбором толщин просвечиваемых растворов L1 и L2. Исходя из этого, имеют место следующие равенства:
ℓg![]() = ℓg
= ℓg![]() следовательно εL1C1 = εL2C2, а так как ε1 = ε2 тогда L1C1 = L2C2.
следовательно εL1C1 = εL2C2, а так как ε1 = ε2 тогда L1C1 = L2C2.
Таким образом — при одинаковой интенсивности окраски одного и того же вещества их концентрации обратно пропорциональны толщине поглощающих слоёв.
Второй вывод. При условии равенства толщин исследуемого раствора и стандартного раствора одного и того же вещества (L1 = L2) зависимость между их оптической плотностью и концентрацией прямопропорциональна:
![]() =
= ![]()
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает свойством аддитивности, которое называют законом аддитивности светопоглощения (аддитивность-лат. additio прибавление-результат получаемый путём сложения). В соответствии с этим законом поглощение света, каким - либо веществом не зависит от присутствия в растворе других веществ, так как каждое из окрашенных веществ будет вносить свою величину в экспериментально определяемую оптическую плотность — Д.
Д = Д1 + Д2 + Д3, т. к. L-const, то имеет место сумма (ε1C1 + ε2C2 + ε3C3)
3.5.3 Спектры поглощения
Все окрашенные соединения характеризуются избирательным поглощением света.
Для характеристики окрашенных растворов различных окрашенных соединений пользуются их спектрами поглощения — кривыми светопоглощения, которые определяют зависимость оптической плотности Д или молярного коэффициента поглощения ε от длины волны λ или частоты γ
Д = f(λ) Д = f(γ)
ε = f(λ) ε = f(γ)
Для получения такого спектра (кривой светопоглощения) в таких координатах — проводят серию измерений оптической плотности или молярного коэффициента светопоглощения при различных длинах волн, измерение проводится вначале через 10 – 20 нм, а после границы максимума измеряют через 1 – 2 нм.
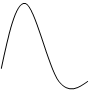
Поглощение света измеряют в оптическом диапазоне спектра в ультрафиолетовой (185 – 400 нм), видимой (400 – 760 нм) и инфракрасной (760 – 1000 нм) областях спектра. Кривые светопоглощения снимают с помощью спектрофотометров, рис 3.3.
У окрашенных веществ максимум поглощения света, в большинстве случаев, находится в видимой области спектра (≈ 500 нм), но не может быть смещен в ультрафиолетовую область (K2CrO4), а также может смещаться и в инфракрасную — (CuSO4).
Спектры поглощения позволяют выбрать оптимальную длину волны для аналитических измерений. Максимуму спектра поглощения соответствует максимальное значение молярного коэффициента поглощения — Еmax, т.е. максимальной чувствительности.
![]() Д 3
Д 3
![]() 1,4 max
1,4 max
—
—
 1,0 — 1
1,0 — 1
![]() —
—
—
—
![]() — 2
— 2
![]()
![]()
![]() • • • • • •
• • • • • •
0 100 200 300 400 500 λ
Рис. 3.3. Спектры поглощения водных растворов хромата (1), дихромата (2) и перманганата (3) калия
Величина Д = ℓg![]() характеризует поглощательную способность вещества, называемую поглощением или светопоглощением — эту величину снимают со шкалы прибора при аналитических определениях. Иногда шкала колибруется на пропускание — Т, %.
характеризует поглощательную способность вещества, называемую поглощением или светопоглощением — эту величину снимают со шкалы прибора при аналитических определениях. Иногда шкала колибруется на пропускание — Т, %.
Между оптической плотностью Д и пропусканием Т существует связь, выражение 3.14.
Т = ![]() · 100
· 100 ![]() =
= ![]()
ℓg![]() = ℓg100 - ℓgТ ℓg
= ℓg100 - ℓgТ ℓg![]() = Д Д = ℓg100 - ℓgТ = 2 - ℓgT
= Д Д = ℓg100 - ℓgТ = 2 - ℓgT
Д = 2 - ℓgT (3.14)
Зависимость оптической плотности от концентрации выражается графиком, рис.3.2.
Тангенс угла наклона (α) градуировочного графика к оси (С) указывает на чувствительность метода. Чем больше угол наклона к оси концентрации градуировочного графика, тем более чувствителен метод определения.
На основании закона Бугера – Ламберта – Бера можно определить нижнюю границу диапазона содержания определяемых веществ (Сmin)
Дmin = Eλ · L · Cmin, если L = 1 см Сmin = ![]()
Использование закона Бугера – Ламберта – Бера позволяет проводить различные расчёты на основании фотометрических измерений и определений.
Пример: Вычислить молярный коэффициент поглощения железа в растворе, содержащем 0,0028 г Fe в 500 мл раствора, при L = 4 см, если Д = 0,28.
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев