Навигация
Прямая потенциометрия – ионометрия
4.2.3 Прямая потенциометрия – ионометрия.
В потенциометрических методах анализа применяют гальванический элемент, состоящих из двух электродов. Один электрод является индикаторным, потенциал его зависит от концентрации (активности) определяемого иона. В качестве индикаторных электродов можно применять ион-селективные электроды, чувствительные на определяемый ион, с мембраной разного вида.
Для измерения потенциала индикаторного электрода в анализируемый раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемого иона и называется электродом сравнения. В качестве электродов сравнения можно применить нормальный водородный электрод, потенциал которого равен нулю при н.у., а также электроды П рода — хлорсеребряный, каломельный и ряд других. Основным требованием к электродам сравнения является постоянство его потенциала, простота изготовления. Постоянство потенциала обеспечивается, если поддерживать постоянной концентрацию внутреннего раствора. Хлорсеребряный электрод (Ag, AgCl/KCl) чаще других применим в качестве электрода сравнения. Его можно применять в паре со стеклянным электродом при определении рН раствора, а также в паре с некоторыми ион-селективными электродами.
Электрохимическая схема пары стеклянный электрод — хлор-серебряный
Ag | AgCl | HCl(0,1) стекло||исслед. р-р || KCl | AgCl | Ag
Стеклянный электрод насыщенный хлор-серебряный
электрод
Во всех проводимых определениях с использованием методов прямой потенциометрии-ионометрии используется зависимость потенциала индикаторного электрода (обычно ион-селективного) от активности или концентрации определяемого компонента, используя для расчётов метод градуировочного графика, метод добавок, молярного свойства и т.д.
Применение ион-селективных электродов позволяет быстро решать многие аналитические задачи и даёт возможность проводить многочисленные задачи на основе составленных матриц. Например, используя ион-селективный электрод (нитрат-селективный) можно быстро и точно определить содержание нитрат-иона в технических, биологических, экологических и других объектах. (Определение нитрат-иона другими методами представляет сложную аналитическую задачу, трудоёмкую, состоящую из нескольких стадий).
Используя ионометрию, составляют гальванический элемент из нитрат-селективного пластифицированного электрода (с плёночной мембраной) и хлорсеребряного электрода сравнения.
По точной навеске методом разбавления готовят серию стандартных растворов KNO3 (или NaNO3), при этом стандартные растворы готовят на фоне 1 м K2SO4, чтобы иметь постоянную ионную силу раствора. Погружают электроды в стандартные растворы (от разбавленного к концентрированному) и регистрируют зависимость ЭДС гальванического элемента от концентрации нитрат-иона, строят калибровочный график Е = f(с) или Е = f(-ℓg c). Затем берут навеску анализируемого образца на аналитических весах (до 0,0001 г) переносят в мерную колбу на 100 мл, добавляют до метки и в том же аппаратном исполнении определяют ЭДС.
По калибровочному графику находят С или -ℓg С
4.3.4 Потенциометрическое титрование
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Как и в прямой потенциометрии, для потенциометрического титрования собирают цепь из индикаторного электрода, чувствительного к определяемому иону и электрода сравнения, но метод имеет ряд преимуществ:
· Позволяет вести определение в присутствии посторонних веществ, влияющих на потенциал индикаторного электрода, путём подбора титранта, реагирующего с определяемым веществом.
· При использовании электродноактивных титрантов позволяет определить вещества, для которых отсутствуют селективные электроды.
При окислительно-восстановительном титровании в качестве индикаторного используют электрод из Pt или другого благородного металла.
При кислотно-основном титровании в качестве индикаторного может быть использован стеклянный электрод или другой рН-чувствительный, например хингидронный.
При реакции осаждения выбирают электрод, чувствительный к определяемому веществу или к применяемому титранту. Например, серебряный электрод может быть применён как индикаторный при осаждении ионов серебра, а так же для определения ионов (Cl -, Br -, CN -, SCN -, AsO43-, CrO42-) образующих малорастворимые соли серебра при использовании в качестве титранта раствора AgNO3.
Комплексонометрическое титрование обычно проводят с металлическими электродами, соли меди — с медным, соли никеля — с никелевым, или соответствующим ион-селективным.
Задача потенциометрического титрования сводится к определению объёма титранта, затраченного на реакцию, к определению точки эквивалентности. Самый удобный и простой способ определения точки эквивалентности по кривой титрования, которая строится по результатам титрования. При этом на оси абсцисс откладывается объём прилитого раствора — (мл), а на оси ординат — соответствующее значение Е (ЭДС) ячейки.
В точке эквивалентности наблюдается резкий скачок ЭДС. В зависимости от выбранной величины кривая титрования может быть интегральной, выражающей прямую зависимость ЭДС системы от объёма прилитого раствора и точка эквивалентности находится по её перегибу (похожа на кривую титрования в методе нейтрализации).
![]() Дифференциальная кривая выражает зависимость изменения величины ΔЕ : ΔV от объёма прилитого рабочего раствора, кривая имеет вид пика, max пика соответствует точке эквивалентности.
Дифференциальная кривая выражает зависимость изменения величины ΔЕ : ΔV от объёма прилитого рабочего раствора, кривая имеет вид пика, max пика соответствует точке эквивалентности.
![]() ΔЕ/ΔV
ΔЕ/ΔV
![]()
![]()
![]()
![]() Qв-ва =
Qв-ва = ![]()
Qв-ва = TVт.э.
![]()
Vт.э. Vмл
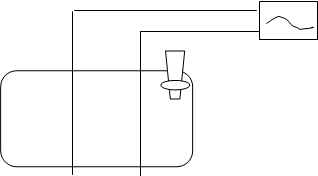
Установка для потенциометрического титрования.
![]()
![]()
![]() 5
5
![]() 4
4
![]() 2
2
![]()
![]()
![]() 3
3
![]()
![]() 1
1
1 — магнитная мешалка
2 — электролит ячейка с анализируемым раствором
3 — индикаторный электрод (ст)
4 — электрод сравнения (Х 1/с)
5 — бюретка
6 — рН метр
Расчёт кривых титрования и скачка титрования в кислотно-основном титровании.
Рассмотрим этапы титрования 100 мл 0,1 н HCl раствором 0,1 н NaOH, в качестве индикаторного используется хингидронный электрод, потенциал которого зависит от [H+]
Ехг. = Е0хг. + 0,059 ℓg[H+]
Е0хг. = 0,099; Ехг. = 0,099 – 0,059 рН; Ехг. = 0,099 + 0,059ℓg[H+]
А) к 100 мл 0,1 н HCl — 90 мл 0,1 н NaOH
[H+] = ![]()
[H+] = ![]() = 5,26 ·10-3
= 5,26 ·10-3
рН = -ℓg5·10-3 = 3ℓg10 - ℓg5 = 2,3
Ехг. = 0,099 – 0,059·2,3 = 0,099 – 0,135 = 0,564
Б) к 100 мл 0,1 н HCl — 99 мл 0,1 н NaOH
[H+] = ![]() =
= ![]() = 5·10-4
= 5·10-4
рН = -ℓg5·10-4 = 4ℓg10 - ℓg5 = 3,3
Ехг. = 0,099 – 0,59·3,3 = 0,699 –0,195 = 0,504
В) к 100 мл 0,1 н HCl — 99,9 мл 0,1 н NaOH
[H+] = ![]() =
= ![]() = 5·10-5
= 5·10-5
рН = -ℓg5·10-5 = 5ℓg10 - ℓg5 = 4,3
Ехг. = 0,699 – 0,059·4,3 = 0,699 – 0,254 = 0,445
Г) в точке эквивалентности рН = 7
Ехг. = 0,699 – 0,059·7 = 0,699 – 0,413 = 0,286
Потенциометрический метод позволяет вести количественное определение смеси кислот, если Kg их различаются не менее, чем на три порядка. При титровании смеси, содержащей соляную и уксусную кислоту на кривой титрования обнаруживается два скачка, первый свидетельствует об окончании титрования HCl, а второй — при оттитровывании СН3СООН. Несколько скачков при титровании многоосновных кислот (H3PO4, H2CrO4 и др).
На основании полученных данных титрования можно построить дифференциальную кривую в координатах ΔЕ/ΔV – V, она будет иметь вид пика.
Д) после достижения Т.Э. — в избытке NaOH добавлено 100,1 мл NaOH
[OH -] = ![]() =
= ![]() = 4,99·10-5
= 4,99·10-5
рОН = -ℓg5·10-5 = 5ℓg10 - ℓg5 = 5 – 0,7 = 4,3
Ехг. = 0,699 – 0,059·9,7 = 0,699 – 0,572 = 0,127
Скачёк титрования от недостатка 0,1 до избытка 0,1 ΔЕ = 0,445 – 0,127 = 0,318
Данные для расчёта дифференциальной кривой (метод нейтрализации).
| Объём раствора NaOH, V мл | ΔV | E | ΔE | ΔE/ΔV |
| 0 | 0,699 | 0,015 | ||
| 9,0 | 0,135 | |||
| 9,0 | 0,564 | 0,066 | ||
| 0,9 | 0,06 | |||
| 9,9 | 0,504 | 0,62 | ||
| 0,09 | 0,059 | |||
| 9,99 | 0,445 | 15,9 | ||
| 0,01 | 0,159 | |||
| 10,0 | 0,286 | 1,59 | ||
| 0,1 | 0,159 | |||
| 10,1 | 0,127 |
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев