Навигация
Метод осаждения
2 Метод осаждения.
а) Ba(NO3) + Na2SO4 → ↓BaSO4 + 2NaNO3
λNa+ = 50,1
λBa+ = 63,6
λNO3- = 71,4
λSO4- = 80,0
Вначале электропроводность уменьшается, вследствие замены более подвижного Ва2+ на менее подвижный Na+, после достижения т.э. — электропроводность увеличивается, за счёт появления избыточного количества сильного электролита Na2SO4/
![]() λ
λ
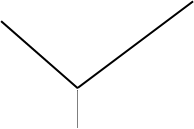
![]() т.э. V
т.э. V
б) 2AgNO3 + BaCl2 → 2AgCl↓ + Ba(NO3)2
λBa2+ = 63,6
λAg+ = 6,2
λNO3- = 71,4
λCl- = 76,0
Ионы Ag+ и Ва2+ обладают равноценной подвижностью, поэтому замещение Ag+ на Ва2+ не влияет на электропроводность, после точки эквивалентности избытка сильного электролита ВаCl2 — вызывает увеличение электропроводности — скачок.

![]() λ
λ
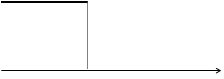
т.э. V
При кондуктометрическом титровании после каждой добавленной порции рабочего раствора измеряют электропроводность (сопротивление).
![]() = ρ (удельная электропроводность величина, обратная сопротивлению)
= ρ (удельная электропроводность величина, обратная сопротивлению)
Сопротивление раствора электролита:
R = ρ ![]() , отсюда x =
, отсюда x = ![]() •
• ![]()
Если бы электропроводность наблюдалась только в объёме между электродами, то для определения удельной электропроводности можно было бы использовать расстояние между электродами – ℓ и их площадь – S.
Но в электролитической ячейке — ток проводит весь раствор — силовые линии находятся и между электродами и вокруг них, площадь электродов изменяется в процессе платинирования.
Поэтому удельную электропроводность выражают зависимостью:
x = A![]()
А — константа сосуда (см-1), зависящая от площади электродов и расстояния между ними, а также от формы сосуда и объёма раствора, проводящего ток ( А = ![]() ).
).
Электропроводность раствора W — величина обратная сопротивлению R
W = ![]() , и поэтому x = A • W
, и поэтому x = A • W
Для определения удельной электропроводности нужно измеренную электропроводность умножить на константу сосуда, т.к. константа сосуда величина постоянная — (одинаковая во всех измерениях) — то для построения кондуктометрической кривой нет необходимости пересчитывать электропроводность раствора W — в удельную электропроводность х, т.к. эти величины пропорциональны друг другу.
Основным требованием предъявляемым к электролитическим ячейкам, является постоянство константы сосуда при неизменном объёме раствора в области тех сопротивлений, которые измеряются в данной ячейке, поэтому для каждой электролитической ячейки, используемой для аналитических целей, предварительно проверяют постоянство константы сосуда.
Для определения константы сосуда измеряют сопротивление стандартного раствора с известной удельной электропроводностью, в качестве стандартных растворов применяют растворы KCl, для которых электропроводность определена с высокой точностью.
Измерение сопротивления стандартных растворов KCl 0,1 н и 0,01 н проводят при постоянном объёме раствора.
4.1.3 Порядок проведения кондуктометрического титрования
1. Собрать установку для кондуктометрического титрования, которая состоит из электролитической ячейки и микробюретки, установленной над сосудом для измерения электропроводности (сопротивления).
2. Определить константу сосуда. Для этого приготовить 0,1 н и 0,01 н растворы KCl. В начале определить сопротивление 25 мл 0,01 н раствора KCl, а затем 25 мл 0,1 н раствора KCl с помощью моста Уинстона. Константу сосуда вычисляют по уравнению:
А = х • R
где: х — удельная электропроводность раствора взятой нормальности
R — сопротивление раствора в ячейке, ом
Значения констант сосуда, установленные по 0,01 н раствору KСl должны быть близкими (6,16 и 6,07 — соответственно и практически не изменяются при увеличении объёма в ячейке).
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев