Навигация
Электрохимические методы анализа
4. Электрохимические методы анализа
Электрохимические методы анализа основаны на использовании зависимости электрохимических параметров — электропроводности, сопротивления, силы тока и др. от концентрации и природы вещества, участвующего в электрохимической реакции. Электрохимические параметры при этом служат аналитическими сигналами, при условии, что они измерены достаточно точно.
Электрохимические методы анализа в практику химического анализа вошли сравнительно давно и занимают в ней важную роль. Впервые потенциометрическое титрование было проведено в 1893 г. в институте Оствальда в Лейпциге, а в 1902 г. появились труды по применению кондуктометрического титрования. А ещё в 1830 г. А.Беккерель провёл осаждение ионов свинца и марганца на положительном электроде в процессе электролиза, тем самым, положив начало электрогравиметрии.
Сейчас электрохимические методы анализа широко применяются во всех технологических процессах, научных работах и т.д., т.к. обладают рядом достоинств. Они позволяют определить концентрацию вещества в широком интервале от 1 до 1•10-9 моль/л с высокой точностью, могут проводиться дистанционно и могут быть легко автоматизированы. Обычно электрохимические методы анализа используют для прямых измерений, основанных на зависимости — “аналитический сигнал — состав”, либо для индикации конечной точки титрования в титриметрии.
Следует отметить, что по первому типу работает большинство приборов автоматического контроля. Одни приборы измеряют электропроводность раствора анализируемого продукта, которая зависит от его концентрации и изменяется пропорционально изменению последней, другие — потенциал электрода, погружённого в раствор анализируемого продукта, величина потенциала также зависит от концентрации ионов.
Методы прямой потенциометрии (ионометрии) основаны на прямом применении уравнения Нернста. Для нахождения концентрации определяемого иона по величине ЭДС цепи или потенциала соответствующего электрода.
В ионометрии сначала по стандартным растворам строят градуировочный график зависимости величины ЭДС или потенциала соответствующего электрода от концентрации определяемого иона или градуируют измерительный прибор (рН-метр, например), а затем измеряя потенциал или ЭДС анализированного раствора — находят его концентрацию. Например, широко применяют этот метод для определения рН раствора, можно использовать также для определения концентрации ионов металлов, анионов и пр.
В настоящее время прямая потенциометрия — ионометрия развивается как новая область физико-химических исследований, основной задачей ионометрии является разработка, изучение и применение широкого круга ион-селективных электродов, обратимых к большому числу катионов и анионов.
Ион-селективные электроды получают на основе самых разнообразных веществ: твёрдых и жидких ионитов, моно- и поликристаллов, хелатов и т.д.
Появление большого числа новых электродов значительно расширело инструментальную базу потенциометрического анализа, с помощью которого осуществляется контроль за ионным составом разнообразных сред.
В объёмном анализе широко применяется косвенная потенциометрия — потенциометрическое титрование, при этом цветной индикатор заменяют электродом. Конечной задачей потенциометрического титрования определяемого компонента рабочим раствором является определение точки эквивалентности по изменению потенциала электрода в эквивалентной точке.
Классификация электрохимических методов анализа.
Электрохимические методы анализа основаны на электрохимических процессах, происходящих в электрохимических системах, состоящих из электродов и электролитов, находящихся в контакте.
Эти методы, основанные на использовании электрохимических свойств анализируемых систем в зависимости от изучаемого аналитического сигнала подразделяются на несколько больших групп — кондуктометрию, потенциометрию, полярографию, электрогравиметрию и т.д.
а) кондуктометрия — метод основан на измерении электропроводности раствора анализируемого электролита, которая зависит от концентрации электролита и изменяется пропорционально изменению концентрации.
б) потенциометрия — метод основан на измерении потенциала электрода, погружённого в анализируемый раствор, величина потенциала зависит от концентрации ионов.
в) полярография — метод основан на изучении зависимости между характером поляризации рабочего электрода и концентрацией раствора, в который он помещён. Полярографию можно применять как для непосредственного определения концентрации анализируемого вещества, так и для определения конечных точек при титровании.
г) Электрогравиметрия — метод основан на выделении из раствора определяемого вещества с помощью электролиза. При этом чистый взвешенный электрод погружают в анализируемый раствор, пропускают постоянный ток, по окончании процесса электролиза электрод вновь взвешивают. По разнице взвешивания находят массу выделившегося на электроде вещества и производят расчёт.
Существуют другие методы, кроме вышеперечисленных, но все они основаны на использовании электрохимических свойств анализируемых систем.
Химические реакции, используемые в ЭХМА.
В электрохимических методах анализа могут быть использованы реакции нейтрализации, осаждения, окисления – восстановления, комплексообразования и др.
Например, в косвенной кондуктометрии (кондуктометрическое титрование) и косвенной потенциометрии (потенциометрическое титрование) очень часто используются реакции осаждения, в результате которых наблюдается изменение электропроводности в первом случае и изменение потенциала — во втором.
Рассмотрим эти случаи.
а) Кондуктометрическое титрование.
Нитрат серебра титруют хлоридом натрия:
Ag+NO3- + Na+Cl - → ↓AgCl + Na+NO3-
Ионы серебра и хлора в процессе титрования удаляются из раствора, образуя осадок, ионы натрия приходят с титрантом и остаются в растворе, заменяя ионы серебра. Такая замена ионов приводит к изменению электропроводности, и характер такого изменения определяется подвижностью ионов, участвующих в этом обмене. В данном случае более подвижные ионы серебра (λ0 = 61,9) уходят из раствора, а вместо них приходят менее подвижные ионы натрия (λ0 = 50,1 ), что естественно, ведёт к уменьшению электропроводности раствора, которая уменьшается до полного осаждения ионов серебра, а после этого электропроводность увеличивается, что фиксируется на кондуктометрической кривой в виде излома. Чем острее угол излома, тем легче установить точку эквивалентности. Острота излома зависит от характера изменения электропроводности после достижения точки эквивалентности. При подборе реагентов в кондуктометрическом титровании следует это учитывать и подбирать таким образом, чтоб реагирующие ионы отличались своими подвижностями.
![]() Е
Е
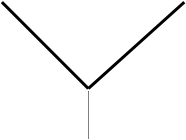
V ![]()
т.э.
б) Потенциометрическое титрование.
AgNO3 + NaCl → AgCl↓ + NaNO3
Здесь титрование нитрата серебра хлоридом натрия проводится с применением индикаторного серебряного электрода, потенциал которого зависит от концентрации ионов серебра и будет изменяться с её изменением в процессе титрования, это отразится на кривой титрования, скачок потенциала отразит точку эквивалентности.
EAg/Ag+ = Exc + 0,059ℓg[Ag+]
К химическим реакциям, применяемым в ЭХМА применяются почти все те требования, что и в обычном титриметрическом анализа:
— скорость реакции должна быть достаточно высокой;
— реакция должна протекать строго по уравнению до конца;
— должны отсутствовать побочные реакции, искажающие электрические характеристики;
— в потенциометрическом титровании выбор реагентов должен обеспечивать резкое изменение потенциала электрода (скачок), который зависит от разности потенциалов электрохимических систем, от величины скачка зависит точность результата;
— в кондуктометрическом титровании выбор реагентов должен обеспечивать острый угол излома на кривой титрования, т.к. от этого зависит точность определения точки эквивалентности, т.е. точности результата.
Похожие работы
... (рв) - на миллиард частей; - кг/м³, г/см³, моль/дм³, кг/т и др. Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле). В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации. В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “ ...
... понимают совокупность тел, находящихся во взаимодействии между собой и отдельных от окружающей среды. Система называется термодинамической, если между ее отдельными частями возможен обмен энергией. Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической. Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
... прибора «Ионометр универсальный ЭВ-74». Дата сбора дождевой воды рН Направление ветра 3. 10. 2004 7 западное 5. 10. 2004 6.3 северо-западное 24.10.2004 6.6 северо-западное 2.2.Качественный анализ дождевой воды. Для проведения качественных реакций на различные ионы отбирали некоторое количество исследуемой дождевой воды, и, создавая нужные условия, добавляли необходимый ...
0 комментариев